Différence entre les cellules primaires et secondaires
Différence clé - cellules primaires et secondaires
Les batteries sont utilisées lorsque le stockage de l'énergie électrique est nécessaire. Ils s'accumulent et offrent des charges électriques comme courant électrique lorsqu'il est nécessaire. Les batteries sont constituées de cellules primaires ou secondaires. Le différence clé entre les cellules primaires et secondaires est la réutilisabilité. Les cellules secondaires peuvent être réutilisées encore et encore tandis que les cellules primaires ne peuvent être utilisées qu'une seule fois. Le but et la charge connectée à la batterie dépendent du type de cellules à l'intérieur. Il peut y avoir une ou plusieurs cellules d'un seul type dans une batterie; de sorte que cela décide de la tension, ou en d'autres termes, la force électromotive (EMF) de cette batterie. Toute cellule se compose de 3 parties principales; à savoir, l'anode, la cathode et l'électrolyte.
Quelles sont les cellules primaires?
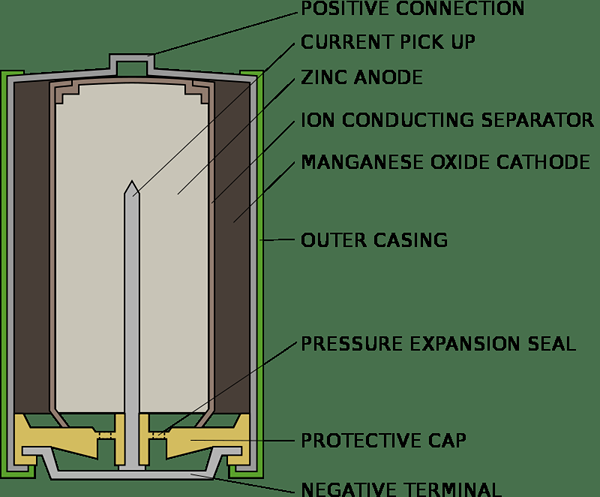
Les cellules primaires peuvent être utilisées une fois et jetées. Ils ne peuvent pas être rechargés et réutilisés. L'étiquette d'une cellule primaire stipule toujours qu'elle ne doit pas être rechargée car il est nocif de tenter de recharger et peut être explosé, si le fais. Les cellules sèches et les cellules de mercure sont des exemples de cellules primaires. La cellule primaire est essentiellement une cellule chimique et produit un courant électrique par une réaction chimique irréversible. Une fois la réaction terminée, il ne peut pas être rétabli. Pour un instant, une cellule sèche est composée d'une cathode en carbone entourée de NH4CL dans un conteneur zink. Une pâte de NH4CL et ZNCL2 sert d'électrolyte tandis que le conteneur de zinc agit comme l'anode. Une petite quantité de MNO2 est également mélangé avec l'électrolyte. Le processus chimique d'une cellule sec peut être résumé comme suit;
Zn-> Zn2++2 électron (réaction de l'anode)
NH4+ + MNO2 + Electron -> MNO (OH) + NH3 (Réaction de la cathode)
Les cellules primaires sont couramment trouvées et utilisées dans la plupart des jouets électriques, des horloges, des montres-bracelets et des télécommandes domestiques.

Que sont les cellules secondaires?
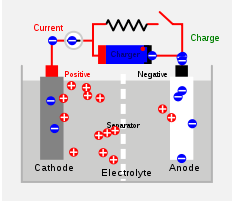
La cellule secondaire est également une cellule chimique mais peut être rechargée pour utiliser à nouveau. La réaction chimique qui produit de l'électricité est réversible, et la cellule peut être utilisée comme nouvelle après le processus de recharge. La cellule peut être réutilisée mais la durée de vie est raccourcie. Le plomb-acide et la cellule de vie sont quelques exemples de cellules secondaires. Dans un Cellule de plomb-acide, Le plomb agit comme l'anode et une grille de plomb rempli de dioxyde de plomb agissent comme la cathode. L'acide sulfurique est rempli pour servir d'électrolyte. Les réactions chimiques à l'intérieur d'une cellule d'acide plomb sont données ci-dessous. Ce sont des processus réversibles.
PB + SO42- --> PBSO4 + 2 électron (réaction de l'anode)
PBO2 + 4h+ + DONC42- + 2 électron -> PBSO4 + 2h2O (réaction de cathode)
Les véhicules hybrides modernes sont alimentés par le pétrole et la puissance électrique. La batterie se charge lorsque la voiture se déplace, puis l'alimentation électrique stockée peut être utilisée pour fonctionner. Toutes les piles à l'intérieur de ces automobiles sont faites de cellules secondaires. Une autre utilisation courante pour les batteries secondaires est le démarrage, l'éclairage et l'allumage dans les véhicules. En outre, ils sont utilisés dans des aliments sans interruption (UPSS), des télécommunications et des outils portables.
Quelle est la différence entre les cellules primaires et secondaires?
Efficacité de la rentabilité:
En utilisant cellules primaires est rentable par rapport aux cellules secondaires, initialement.
Mais en utilisant cellules secondaires serait un investissement à long terme car les cellules primaires doivent être remplacées par un autre ensemble après un certain temps.
Taux d'auto-décharge:
Cellules primaires ont un taux d'auto-décharge inférieur, ils conviennent donc aux dispositifs de fonctionnement de secours qui ont besoin de petits courants en continu pendant longtemps. C'est un fait important au nom des équipements de sécurité tels que les détecteurs de fumée / incendie, les alarmes de cambrioleurs et les horloges.
Cellules secondaires avoir une auto-décharge plus élevée.
Coût et utilisation:
Cellules primaires sont bon marché et faciles à utiliser.
Cellules secondaires sont chers et plus complexes en usage.
Image gracieuseté:
1. «Alcalin-Battery-English» par Tympan [Domaine public] via Commons
2. Diagramme cellulaire secondaire par l'auteur original: Barrie Lawson. [CC BY-SA 3.0], via Wikimedia Commons


