Différence entre le phosphine et le phosgène
Le différence clé entre le phosphine et le phosgène est que La phosphine est un composé inorganique, tandis que le phosgène est un composé organique.
Le phosphine et le phosgène sont des gaz incolores. Bien que leurs noms semblent similaires, ce sont deux composés différents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la phosphine
3. Qu'est-ce que le phosgène
4. Comparaison côte à côte - phosphine vs phosgène sous forme tabulaire
5. Résumé
Qu'est-ce que la phosphine?
La phosphine est un composé inorganique ayant la formule chimique pH3. C'est un gaz incolore et inflammable ayant une odeur légèrement désagréable. L'odeur désagréable survient en raison de la présence de phosphine substituée et de diphosphane. De plus, ce composé est un gaz toxique. Et, ce gaz brûle spontanément dans l'air, produisant une flamme lumineuse. De plus, il brûle, produisant de l'acide phosphorique comme un nuage blanc dense.
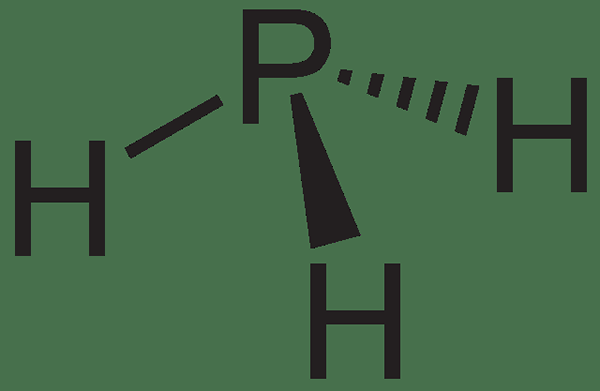
Figure 01: Structure de la phosphine
La masse molaire de ce composé est 33.99 g / mol. Le point de fusion est −132.8 ° C tandis que le point d'ébullition est -87.7 ° C. Lorsque vous envisagez la structure, c'est une molécule pyramidale trigonale. L'angle de liaison des liaisons H-P-H est 93.5 °. De plus, il a un moment dipolaire en raison de la présence d'une paire d'électrons solitaires; Le moment dipolaire de cette molécule augmente avec la substitution des groupes méthyle, tandis qu'il diminue avec la substitution de l'ammoniac.
Qu'est-ce que le phosgène?
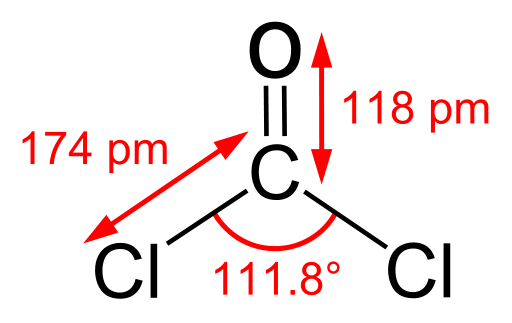
Le phosgène est un composé organique ayant la formule chimique COCl2. C'est un gaz incolore, et il a une odeur similaire à l'herbe fraîchement coupée. De plus, il est insoluble dans l'eau mais peut réagir avec l'eau. Il a une géométrie planaire trigonale et l'angle de liaison Cl-C-Cl est 111.8 °. De plus, ce composé est un simple chlorure d'acyle qui se forme à partir de l'acide carbonique.

Figure 02: Structure du phosgène
À l'échelle industrielle, nous produisons du phosgène en passant le monoxyde de carbone pur et le chlore gazeux par du carbone activé. Ici, le carbone activé est le catalyseur. De plus, cette réaction est exothermique, et nous devons refroidir le réacteur pendant la réaction. Lorsque vous envisagez les utilisations du phosgène, nous pouvons l'utiliser dans la production d'isocyanates, dans la synthèse des carbonates, etc.
Quelle est la différence entre le phosphine et le phosgène?
Bien que les noms de phosphine et de phosgène semblent similaires, ce sont deux composés différents. La principale différence entre le phosphine et le phosgène est que la phosphine est un composé inorganique, tandis que le phosgène est un composé organique. De plus, la phosphine se produit comme un gaz incolore, inflammable et toxique avec une odeur légèrement désagréable tandis que le phosgène se produit comme un gaz incolore avec l'odeur de l'herbe fraîchement coupée. Lorsque vous envisagez la structure, la géométrie de la molécule de phosphine est pyramidale trigonale, tandis que la géométrie du phosgène est planaire trigonale. De plus, la phosphine est mal soluble dans l'eau, mais le phosgène est insoluble, et si nous l'ajoutons à l'eau, il peut réagir avec de l'eau plutôt que de simplement se dissoudre là-bas.
L'infographie ci-dessous résume la différence entre le phosphine et le phosgène, comparativement.

Résumé - Phosphine vs phosgène
Bien que les noms de phosphine et de phosgène semblent similaires, ce sont deux composés différents. Principalement, la principale différence entre le phosphine et le phosgène est que la phosphine est un composé inorganique, tandis que le phosgène est un composé organique.
Référence:
1. "Phosgène.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «Phosgène-dimensions-2d» par Neurotiker - Propre travaux (domaine public) via Commons Wikimedia
2. «Monophosphan» par phosgène-dimensions-2d.PNG: Ben Millssvg-Version: N-Regen - Phosgène-dimensions-2d.PNG (domaine public) via Commons Wikimedia


