Différence entre l'oxygène et l'ozone

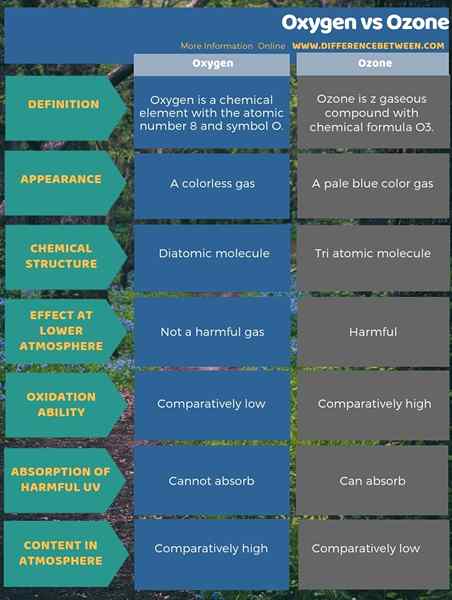
Le différence clé entre l'oxygène et l'ozone est que le L'oxygène est une molécule gazeuse diatomique de l'élément d'oxygène, tandis que l'ozone est une molécule triatomique d'oxygène.
L'oxygène gazeux et l'ozone sont les allotropes les plus familiers de l'élément d'oxygène. L'oxygène est un gaz extrêmement important pour les organismes vivants; pour leur respiration. L'ozone protège également la vie sur Terre lorsqu'elle est dans la haute atmosphère, mais dans l'atmosphère inférieure, elle est nuisible.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxygène
3. Qu'est-ce que l'ozone
4. Comparaison côte à côte - oxygène vs ozone sous forme tabulaire
5. Résumé
Qu'est-ce que l'oxygène?
L'oxygène est un élément chimique avec le numéro 8 atomique, qui est présent dans le groupe 16 du tableau périodique. Il a la configuration électronique 12 2s2 2p4. L'oxygène a trois isotopes majeurs; 16O, 17O, 18O. Parmi ceux-ci, 16O est l'isotope le plus abondant. De plus, l'atome d'oxygène a huit électrons, et il peut obtenir deux autres électrons d'un autre atome pour former un anion chargé -2. Alternativement, deux atomes d'oxygène peuvent partager quatre électrons pour former une liaison covalente qui donne la molécule diatomique (o2).
Le poids moléculaire de o2 est 32 g mol-1. C'est un gaz incolore, inodore et insipide. Il y a environ 21% de l'oxygène dans l'atmosphère terrestre. De plus, il est mal soluble dans l'eau et est légèrement plus lourd que l'air. L'oxygène a également des propriétés magnétiques. Lorsque l'oxygène gazeux se condense à -183 ° C, il devient un liquide de couleur bleuâtre.

Figure 01: À des fins de soudage, nous avons besoin d'oxygène pour produire une flamme d'oxy-acétylène
De plus, ce gaz réagit avec tous les éléments pour former des oxydes à l'exception des gaz inertes. Par conséquent, c'est un bon agent oxydant. L'oxygène est essentiel à la respiration des organismes vivants. Nous utilisons ce gaz dans les hôpitaux, le soudage et dans de nombreuses autres industries.
Qu'est-ce que l'ozone?
La forme à trois atomiques d'oxygène est l'ozone, et c'est une forme courante d'oxygène. Dès que nous entendons le nom Ozone, nous pensons à la couche d'ozone. La couche d'ozone est présente dans la stratosphère au niveau atmosphérique supérieur, et il absorbe le rayonnement UV nocif, le restreignant ainsi à la surface de la Terre.
Cependant, l'ozone est nocif à des niveaux atmosphériques inférieurs. Il agit comme un polluant atmosphérique (responsable du smog photochimique) et peut provoquer des maladies respiratoires aux humains et aux animaux. De plus, il endommage également les plantes. L'ozone est moins stable que l'oxygène gazeux, par conséquent; se briser en gaz d'oxygène plus stable.
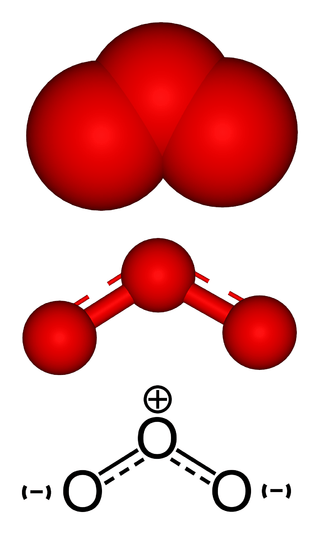
Figure 02: Structure hybride de la molécule de gaz d'ozone
Le gaz d'ozone est un gaz de couleur bleu pâle avec une odeur pointue. Il est plus soluble dans les solvants non polaires et moins soluble dans l'eau. De plus, deux atomes d'oxygène dans l'ozone se lient avec une double liaison, et il y a une liaison dative entre un atome d'oxygène avec un autre atome d'oxygène.
Cependant, il montre la stabilisation de la résonance; Ainsi, la structure réelle de cette molécule est une structure hybride. Là, la longueur de liaison O-O est similaire entre trois atomes. L'atome d'oxygène central a SP2 hybridation avec une paire seule. De plus, l'ozone a plié la géométrie. Aussi, c'est une molécule polaire. Et, comme c'est un fort agent oxydant, l'ozone est très réactif. D'ailleurs, ce gaz se forme à partir de l'oxygène lorsqu'il y a la lumière du soleil.
Quelle est la différence entre l'oxygène et l'ozone?
L'oxygène est un élément chimique avec le nombre atomique 8 et le symbole O et l'ozone est un composé gazeux avec une formule chimique O3. Généralement, lorsque nous disons de l'oxygène, nous nous référons à l'oxygène gazeux. Par conséquent, la principale différence entre l'oxygène et l'ozone est que l'oxygène est une molécule gazeuse diatomique de l'élément d'oxygène, tandis que l'ozone est une molécule gazeuse triatomique de l'oxygène. De plus, il y a une différence entre l'oxygène et l'ozone dans leurs couleurs également. C'est-à-dire; L'oxygène est un gaz incolore, mais l'ozone est un gaz bleu pâle.
En outre, une autre différence significative entre l'oxygène et l'ozone est que le gaz d'ozone peut être nocif à des niveaux atmosphériques plus faibles mais que l'oxygène n'est pas un gaz nocif. En outre, dans l'atmosphère, l'oxygène gazeux se produit en quantités beaucoup plus élevées que l'ozone. En dehors de cela, l'ozone est moins stable que l'oxygène. Par conséquent, la capacité d'oxydation de l'ozone est supérieure à celle de l'oxygène.
L'infographie ci-dessous sur la différence entre l'oxygène et l'ozone montre les différences de forme tabulaire.
Résumé - Oxygène vs ozone
L'oxygène et l'ozone sont les deux composés gazeux majeurs de l'élément chimique oxygène. La principale différence entre l'oxygène et l'ozone est que l'oxygène est une molécule gazeuse diatomique de l'élément d'oxygène, tandis que l'ozone est une molécule triatomique d'oxygène.
Référence:
1. "Ozone.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. "Oxygène.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.»GMAW.soudage.un F.NCS »par William M. Plaque JR. (Domaine public) via Commons Wikimedia
2.«Ozone-Montage» (domaine public) via Commons Wikimedia