Différence entre l'oxyde et le dioxyde
Le différence clé entre l'oxyde et le dioxyde est que L'oxyde est tout composé ayant un ou plusieurs atomes d'oxygène combinés à un autre élément chimique, tandis que le dioxyde est un oxyde contenant deux atomes d'oxygène dans sa molécule.
Le terme oxyde est un terme général qui décrit la présence d'atomes d'oxygène dans un composé. Ici, le ou l'atome d'oxygène existe en combinaison avec un autre élément chimique; principalement des métaux et des non-métaux. Selon le nombre d'atomes d'oxygène dans le composé, nous pouvons les nommer comme monoxyde, dioxyde, trioxyde, etc. Par conséquent, le dioxyde est un oxyde contenant deux atomes d'oxygène par molécule.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'oxyde
3. Qu'est-ce que le dioxyde
4. Comparaison côte à côte - oxyde vs dioxyde sous forme tabulaire
5. Résumé
Qu'est-ce que l'oxyde?
L'oxyde est tout composé ayant un ou plusieurs atomes d'oxygène combinés à un autre élément chimique. «L'oxyde» ici est l'anion divalent (o2-). En règle générale, les oxydes métalliques contiennent ce dianion dans lequel l'atome d'oxygène est à l'état d'oxydation -2. À l'exception des gaz inertes légers (y compris l'hélium, le néon, l'argon et le krypton), l'oxygène peut former des oxydes avec tous les autres éléments.
Dans la formation d'un oxyde, les métaux et les non-métaux peuvent montrer leurs états d'oxydation les plus bas et les plus élevés. Certains oxydes sont des composés ioniques; Les métaux alcalins, les métaux de la terre alcaline et les métaux de transition forment ces oxydes ioniques. D'autres composés ont une nature covalente; les métaux à forte oxydation peuvent former des oxydes covalents. De plus, les non-métaux forment des composés d'oxyde covalent.
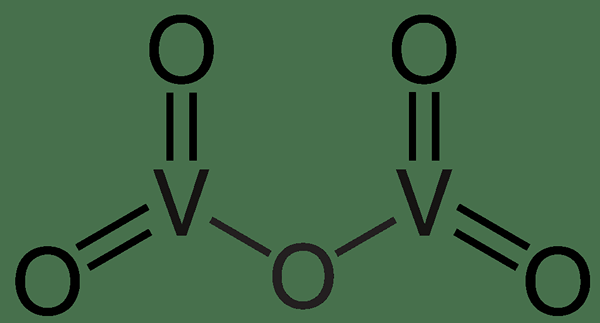
Figure 01: Oxyde de vanadium (V)
Dans l'image ci-dessus, l'atome de métal de vanadium a une valence de 5 (valence totale est de 10 pour deux atomes de vanadium) ainsi, cinq atomes d'oxygène (avec une valence de 2 pour chaque atome d'oxygène) lié à eux.
De plus, certains composés organiques réagissent également avec l'oxygène (ou les agents oxydants) pour produire des oxydes, e.g. oxydes d'amine, oxydes de phosphine, sulfoxydes, etc. De plus, le nombre d'atomes d'oxygène dans le composé détermine s'il s'agit d'un monoxyde, d'un dioxyde ou d'un trioxyde.
Selon leurs propriétés, il est également possible de les classer comme des oxydes acides, de base, neutres et amphotériques. L'oxyde acide peut réagir avec les bases et former des sels. Ex: trioxyde de soufre (SO3). Les oxydes de base réagissent avec les acides et forment des sels. Ex: oxyde de sodium (NA2O). Le neutre ne montre ni les propriétés acides ni basiques; Ainsi, ils ne forment pas de sels en réagissant avec les acides ou les bases. Ex: monoxyde de carbone (CO). Les oxydes amphotériques ont des propriétés acides et de base; Par conséquent, ils réagissent avec les acides et les bases pour former des sels. Ex: oxyde de zinc (ZnO).
Qu'est-ce que le dioxyde?
Le dioxyde est un oxyde contenant deux atomes d'oxygène dans sa molécule. Une molécule doit contenir un élément chimique avec une valence de 4 afin de former un dioxyde. C'est parce qu'un atome d'oxygène montre une valence de 2. Par exemple, dans le dioxyde de carbone, la valence du carbone est 4.

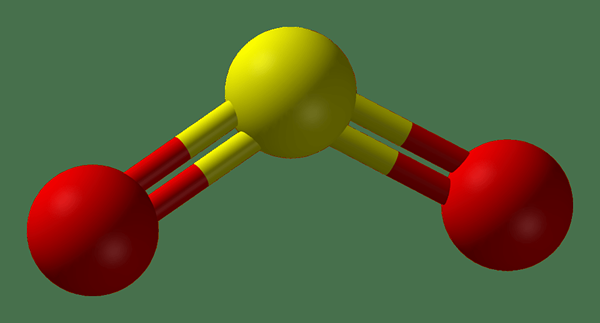
Figure 02: Structure de la balle et du bâton du dioxyde de soufre
Quelques exemples de dioxydes
- Dioxyde de carbone (CO2)
- Dioxyde d'azote (non2)
- Oxygène (o2)
- Quartz ou dioxyde de silicium (Sio2)
Quelle est la différence entre l'oxyde et le dioxyde?
Le dioxyde est un type d'oxyde. La principale différence entre l'oxyde et le dioxyde est que l'oxyde est tout composé ayant un ou plusieurs atomes d'oxygène combinés à un autre élément chimique, tandis que le dioxyde est un oxyde contenant deux atomes d'oxygène dans sa molécule. Lorsque l'on considère la valence des oxydes, la valence de l'oxygène est 2 et la valence des autres éléments peut varier; Cependant, pour les dioxydes, la valence de l'oxygène est 2 et la valence d'autres éléments est essentiellement 4. Ainsi, nous pouvons considérer cela aussi comme une différence entre l'oxyde et le dioxyde.

Résumé - Oxyde vs dioxyde
L'oxyde est un terme général que nous utilisons pour nommer n'importe quel composé contenant des atomes d'oxygène en combinaison avec un autre élément. De plus, selon le nombre d'atomes d'oxygène, nous pouvons les nommer comme monoxyde, dioxyde, trioxyde, etc. La principale différence entre l'oxyde et le dioxyde est que l'oxyde est tout composé ayant un ou plusieurs atomes d'oxygène combinés à un autre élément chimique, tandis que le dioxyde est un oxyde contenant deux atomes d'oxygène dans sa molécule.
Référence:
1."Oxyde." Wikipédia, Fondation Wikimedia, 2 juin 2019, disponible ici.
Image gracieuseté:
1. «Vanadium (V) Oxyde» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia
2. «Soufre-dioxyde-3D-balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


