Différence entre l'octane et le cétane
Le différence clé entre l'octane et le cétane est que L'octane a 8 atomes de carbone tandis que le cétane a seize atomes de carbone par molécule. De plus, l'octane est très volatile tandis que Cetane n'est pas volatile.
Ce sont des composés d'hydrocarbures qui sont utilisés comme références pour le classement de différents carburants du moteur en fonction de leurs performances (cote d'octane et cote de cétane). De plus, ce sont des liquides incolores à température ambiante qui subissent facilement l'allumage.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'octane
3. Qu'est-ce que Cetane
4. Comparaison côte à côte - octane vs cétane sous forme tabulaire
5. Résumé
Qu'est-ce que l'octane?
L'octane est un hydrocarbure inflammable ayant la formule chimique C8H18. C'est aussi un alcane (pas de doubles liaisons ou triples liaisons présentes entre deux atomes). Étant donné que ce composé est un hydrocarbure de faible poids moléculaire, il est très volatil (la phase liquide se transforme facilement en phase de vapeur). Ce liquide est moins dense que l'eau; Par conséquent, il flotte sur l'eau. C'est parce qu'il est insoluble dans l'eau car il s'agit d'un liquide non polaire (l'eau est un solvant polaire). De plus, il peut former une odeur irritante par volatilisation.
Propriétés chimiques octane
Certains faits chimiques sur ce composé sont les suivants:
- Formule chimique = C8H18
- Masse molaire = 114.23 g / mol
- Point de fusion = -56.8 ° C
- Point d'ébullition = 126 ° C
- Apparence = liquide incolore
- Odeur = odeur de type essence
Figure 01: molécule d'octane (non ramifié)
Octane est un terme utilisé dans le classement des différentes notes de carburant. Il mesure la propriété Antiknock d'un carburant, en d'autres termes, il mesure le degré d'effet de frappe lorsqu'il est dans un moteur. Ce système de notation classe un carburant selon un carburant de référence; Un mélange d'isooctane et d'heptane. L'effet de frappe de l'isooctane est un effet minimal qui le conduit à classer l'isooctane à 100 (tandis que l'heptane a un effet de coup maximal qui le conduit à classer l'heptane comme 0). Par conséquent, la ramification de la molécule d'octane est élevée, la note d'octane est élevée.
Qu'est-ce que Cetane?
Le cétane est un hydrocarbure ayant la formule chimique C16H34. Le nom IUPAC de ce composé est l'hexadécane. C'est un alcane très inflammable. Ce composé est également moins dense que l'eau, donc il flotte sur l'eau. Cependant, il ne se mélange pas avec de l'eau en raison de sa propriété non polaire. Contrairement à l'octane, l'hexadécane n'est pas volatile car il s'agit d'un hydrocarbure de poids moléculaire.
Propriétés chimiques Cetane
Certains faits chimiques importants sur ce composé sont les suivants:
- Formule chimique = C16H34
- Masse molaire = 226.45 g / mol
- Point de fusion = 18 ° C
- Point d'ébullition = 287 ° C
- Apparence = liquide incolore
- Odeur = odeur de type essence

Figure 02: La structure chimique de l'isocotane
Numéro de cétane (ou note) est la mesure de la vitesse de combustion d'un carburant diesel. En d'autres termes, c'est une mesure du retard de l'allumage du diesel. De plus, il mesure la compression requise pour l'allumage de ce carburant. Un numéro de cétane inférieur indique que le carburant a un temps de retard d'allumage plus long et vice versa.
Quelle est la différence entre l'octane et le cétane?
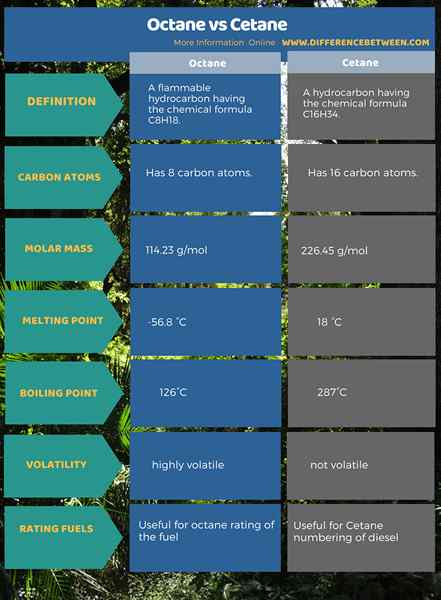
L'octane est un hydrocarbure inflammable ayant la formule chimique C8H18 tandis que le cétane est un hydrocarbure ayant la formule chimique C16H34. L'octane avait 8 atomes de carbone tandis que Cetane a 16 atomes de carbone. La masse molaire de l'octane est de 114.23 g / mol. D'un autre côté, la masse molaire de cétane est 226.45 g / mol.
Compte tenu des points de fusion et d'ébullition des deux composés, l'octane a un point de fusion de -56.8 ° C alors qu'il est à 18 ° C en cétane. Le point d'ébullition de l'octane est de 126 ° C alors qu'il est à 287 ° C en cétane. De plus, l'octane est très volatile tandis que Cetane n'est pas volatile. Et ces deux hydrocarbures sont utiles dans les combustibles de notation où l'octane est utilisé pour évaluer le carburant et le cétane est utilisé pour compter le diesel.
Résumé - Octane vs Cetane
L'octane et le cétane sont facilement des composés d'hydrocarbures inflammables. Ce sont des liquides incolores à température ambiante avec une odeur de type essence. La différence entre l'octane et le cétane est que l'octane a 8 atomes de carbone tandis que le cétane a seize atomes de carbone par molécule.
Référence:
1. "Octane.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. "Octane.»Wikipedia, Wikimedia Foundation, 17 mai 2018. Disponible ici
3. «Hexadécane.»Wikipedia, Wikimedia Foundation, 17 mai 2018. Disponible ici
Image gracieuseté:
1.'Octane 3d Ball'By Jynto (Talk) - Propre travaux (CC0) via Commons Wikimedia
2.'ISOCETANE3D'BY EDGAR181 - Propre travaux, (domaine public) via Commons Wikimedia


