Différence entre isotonique et isosmotique
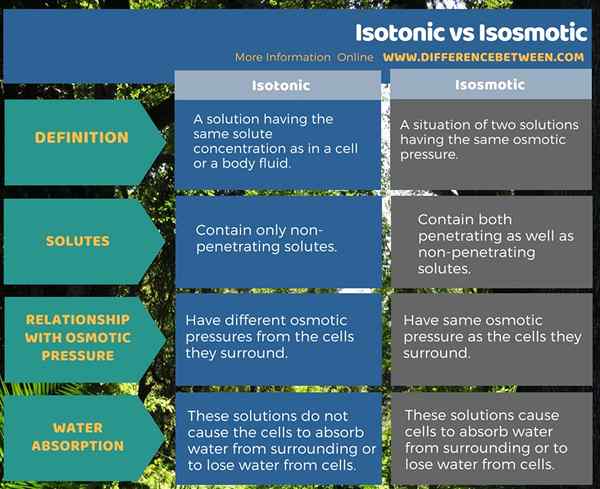
Le différence clé entre isotonique et isosmotique est que Les solutions isotoniques ne contiennent que des solutés non pénétrants tandis que les solutions isosmotiques contiennent à la fois des solutés pénétrants et non pénétrants. Une autre différence importante entre les solutions isotoniques et isosmotiques est que les solutions isotoniques ont des pressions osmotiques différentes des cellules qu'elles entourent tandis que les solutions isosmotiques ont la même pression osmotique que les cellules qu'elles entourent.
Isotonique et isosmotique sont des types de solutions et de termes que nous rencontrons souvent dans les laboratoires de chimie. Beaucoup restent confus quant à la différence entre les deux types de solutions croyant qu'ils sont les mêmes. Cependant, ils ne sont pas les mêmes et nous mettrons en évidence leurs différences dans cet article.
CONTENU
1. Aperçu et différence clé
2. Que sont les solutés
3. Qu'est-ce que l'isotonique
4. Qu'est-ce que l'isosmotique
5. Comparaison côte à côte - Isotonique vs isosmotique sous forme tabulaire
6. Résumé
Que sont les solutés?
Les solutés sont les substances qui se dissolvent dans une solution. Pour comprendre les solutions isosmotiques et isotoniques, nous devons réaliser qu'ils pénètrent soit des solutés ou des solutés non pénétrants. Les solutés pénétrants sont ceux qui peuvent passer à travers les membranes de la cellule affectant la pression osmotique à travers la membrane. D'un autre côté, les solutés non pénétrants ne peuvent pas traverser la membrane, c'est pourquoi ils affectent seulement la tonicité.
Qu'est-ce que l'isotonique?
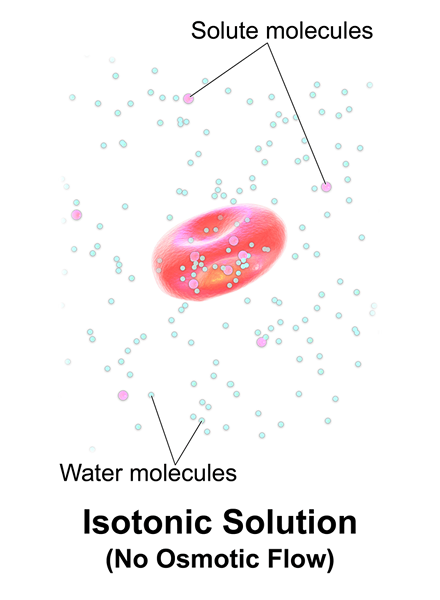
Isotonique, c'est quand une solution a la même concentration de sel que le sang et les cellules du corps humain. Les solutions isotoniques ne contiennent que des solutés non pénétrants et il fait référence à des solutions ayant la même pression osmotique que les cellules qu'elles entourent.

Figure 01: Solution isotonique
De plus, ils n'absorbent rien de la cellule et vice versa (les cellules n'absorbent pas non plus les solutés de ces solutions). Par exemple, une solution de 154 mmnacl est isotonique pour les êtres humains.
Qu'est-ce que l'isosmotique?
Isosmotique, c'est quand deux solutions ont le même nombre de solutés. Ainsi, malgré le fait qu'ils ont la même pression osmotique que la cellule, ils entourent. Ils contiennent des solutés pénétrants qui peuvent entrer et augmenter la pression osmotique de la cellule. Lorsque la pression osmotique de la cellule augmente, ce qui fait que la cellule absorbe l'eau du milieu, elle atteint l'équilibre et la pression osmotique est égale des deux côtés. Cela peut avoir un effet sur la cellule afin qu'il puisse enfin éclater.
Par exemple, le saccharose est une solution qui n'a pas d'ions. Une solution de saccharose de 320 mm est isosmotique pour les êtres humains. En comparant cette solution de saccharose avec une solution de NaCl 154 mm, il révèle qu'il est de 154 mmsodium (Na) et de 154 mmchlorure (CL) ou d'environ 308 milliosmolaires, ce qui est près de 320 milliosmolaires pour le saccharose.
Quelle est la différence entre isotonique et isosmotique?
Isotonique fait référence à une solution ayant la même concentration de soluté que dans une cellule ou un liquide corporel. Isosmotique fait référence à la situation de deux solutions ayant la même pression osmotique. Par conséquent, les solutions isotoniques ne contiennent que des solutés non pénétrantes tandis que les solutions isosmotiques contiennent à la fois des solutés pénétrants et non pénétrants.
En considération dans la relation, ces deux types de solutions ont avec la pression osmotique, les solutions isotoniques ont des pressions osmotiques différentes des cellules qu'elles entourent. Au contraire, les solutions isosmotiques ont la même pression osmotique que les cellules qu'elles entourent. De plus, les solutions isotoniques ne font pas absorber les cellules les cellules de l'environnement ou de perdre l'eau des cellules. Cependant, les solutions isosmotiques amènent les cellules à absorber l'eau de l'environnement ou de perdre l'eau des cellules.
Résumé - Isotonique vs isosmotique
Les termes isotoniques et isosmotiques sont utiles pour décrire les propriétés des liquides corporels. Les deux termes, Isotonic exprime l'idée d'avoir les mêmes concentrations de soluté tandis que le terme isosmotique exprime l'idée d'avoir des pressions osmotiques égales. La différence entre les solutions isotoniques et isosmotiques est que les solutions isotoniques ne contiennent que des solutés non pénétrantes tandis que les solutions isosmotiques contiennent à la fois des solutés pénétrants et non pénétrants.
Référence:
1. "Tonicité.»Wikipedia, Wikimedia Foundation, 8 février. 2018. Disponible ici
2. «Isosmotique.»Biologie en ligne. Disponible ici
Image gracieuseté:
1.'Blausen 0685 OsmoticFlow isotonic'By Blausen.COM PERSONNEL (2014). «Médicale Galerie de Blausen Medical 2014». Wikijournal de médecine 1 (2). Doi: 10.15347 / WJM / 2014.010. ISSN 2002-4436. - Propre travail, (CC par 3.0) via Commons Wikimedia


