Différence entre le dioxyde de nitrite et d'azote
Le différence clé entre le dioxyde de nitrite et d'azote est que le Le nitrite est un anion tandis que le dioxyde d'azote est une molécule.
Le dioxyde de nitrite et d'azote a le même nombre d'atomes d'azote et d'oxygène; un atome d'azote et deux atomes d'oxygène. Même la structure du composé est similaire. Mais, ils sont différents les uns des autres selon la charge électrique qu'ils portent sur eux. Discutons de plus de détails à leur sujet.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le nitrite
3. Qu'est-ce que le dioxyde d'azote
4. Comparaison côte à côte - Nitrite vs dioxyde d'azote sous forme tabulaire
5. Résumé
Qu'est-ce que le nitrite?
Le nitrite est un anion ayant la formule chimique no-2. Ce composé a deux liaisons chimiques covalentes avec des longueurs de liaison égales. De plus, cet anion est un ion symétrique. Par conséquent, il peut subir une oxydation ou une réduction. En conséquence, il peut agir à la fois comme un agent réducteur et un agent oxydant.

Figure 01: Structure de l'ion nitrite
La masse molaire de cet anion est 46.01 g / mol. Lors de la protonation, cet anion forme un acide nitreux qui est un acide faible instable. Cet anion peut également former des sels et des complexes de coordination. De plus, il y a des nitrites organiques qui se composent d'esters d'acide nitreux.
Qu'est-ce que le dioxyde d'azote?
Le dioxyde d'azote est un composé inorganique ayant la formule chimique NO2. De plus, c'est un composé neutre avec une charge électrique nulle. La masse molaire de ce composé est 46.05 g / mol. Il se produit comme un gaz qui apparaît dans une couleur orange. Cependant, il a une odeur piquante comme dans le chlore gazeux.

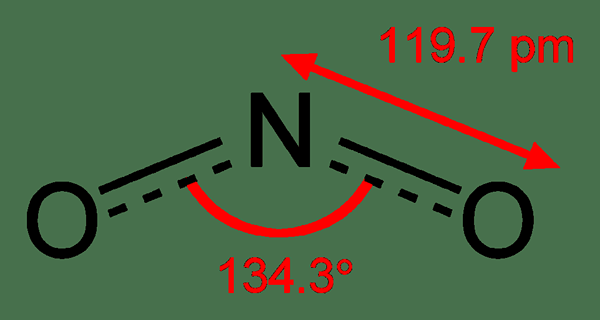
Figure 02: Structure chimique du dioxyde d'azote
De plus, ce composé est paramagnétique. Les longueurs de liaison entre l'atome d'azote et les atomes d'oxygène sont égales; La longueur de liaison de chaque liaison est 119.19 h. C'est un agent oxydant fort. Il peut également subir une réduction.
Quelle est la différence entre le dioxyde de nitrite et d'azote?
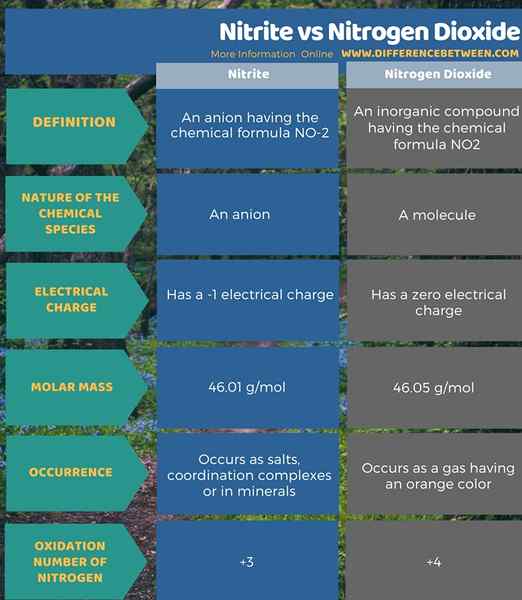
Le nitrite est un anion ayant la formule chimique no-2. C'est un anion. La masse molaire de cet anion est 46.01 g / mol. L'atome d'azote de cet anion a +3 l'état d'oxydation. Il peut former des sels, des complexes de cornation ou se produit en minéraux. D'un autre côté, le dioxyde d'azote est un composé inorganique ayant la formule chimique NO2, et c'est un composé neutre ayant une charge électrique nulle. La masse molaire de ce composé est 46.05 g / mol. Il se produit comme un gaz avec une apparence de couleur orange. De plus, l'atome d'azote de cette molécule a un état d'oxydation +4. Ce sont les principales différences entre le dioxyde de nitrite et d'azote.
Résumé - Nitrite vs dioxyde d'azote
Le dioxyde de nitrite et d'azote a la même formule moléculaire mais ils ont de nombreuses différences comme indiqué ci-dessus. La principale différence entre le dioxyde de nitrite et d'azote est que le nitrite est un anion tandis que le dioxyde d'azote est une molécule.
Référence:
1. "Nitrite.»Wikipedia, Wikimedia Foundation, 3 juillet 2018. Disponible ici
2. «Dioxyde d'azote.»Wikipedia, Wikimedia Foundation, 10 juillet 2018. Disponible ici
Image gracieuseté:
1.'Nitriteion-Resonance-Hybrid'by Yikrazuul - Propre travaux, (domaine public) via Commons Wikimedia
2.«Nitrogen-dioxyde-2d-dimensions» par Ben Mills - Propre travaux, (domaine public) via Commons Wikimedia


