Différence entre molécule et réseau

Le différence clé entre la molécule et le réseau la molécule contient des atomes liés les uns aux autres alors qu'un réseau contient des atomes, des molécules ou des ions liés les uns aux autres.
Les atomes se réunissent pour former diverses substances chimiques. Selon leur arrangement, leurs propriétés changent. L'unité la plus simple qui peut se former lorsque les atomes se lient entre eux est une molécule. Si un très grand nombre d'atomes, d'ions ou de molécules se combinent les uns avec les autres, alors le résultat est un réseau. Un réseau a une structure hautement ordonnée et une masse molaire très élevée.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une molécule
3. Qu'est-ce qu'un réseau
4. Comparaison côte à côte - molécule vs réseau sous forme tabulaire
5. Résumé
Qu'est-ce qu'une molécule?
Les molécules sont constituées de deux atomes liés chimiquement ou plus du même élément (e.g., O2, N2) ou différents éléments (h2O, NH3). Les molécules n'ont pas de charge et les atomes se lient entre eux via des liaisons covalentes. De plus, ils peuvent être très grands (hémoglobine) ou très petits (h2), selon le nombre d'atomes qui se connectent les uns aux autres.

Figure 01: une molécule d'eau
La formule moléculaire d'une molécule montre le type et le nombre d'atomes dans une molécule. La formule empirique donne le rapport entier le plus simple d'atomes présents dans une molécule. Par exemple, C6H12O6 est la formule moléculaire du glucose et ch2O est la formule empirique. La masse moléculaire est la masse que nous calculons compte tenu du nombre total d'atomes dans la formule moléculaire. De plus, chaque molécule a sa propre géométrie. De plus, les atomes d'une molécule s'organisent de manière la plus stable avec un angle de liaison et des longueurs de liaison spécifiques pour minimiser les répulsions et les forces de déformation.
Qu'est-ce qu'un réseau?
Le réseau est un grand réseau d'atomes qui a une structure ordonnée. En chimie, nous pouvons voir différents types de réseaux ioniques et covalents. Nous pouvons définir un réseau comme un solide qui a une disposition ordonnée en trois dimensions des unités de base. L'unité de base peut être un atome, une molécule ou un ion. Ainsi, les réseaux sont des structures cristallines avec ces unités de base répétées.
De plus, si ce réseau contient des ions joints à des liaisons ioniques, nous les appelons comme des cristaux ioniques. Par exemple, le chlorure de sodium est un réseau ionique. Le sodium est un métal du groupe 1, forme donc un cation chargé de +1 comme son cation le plus stable. Le chlore est un non-métal et a la capacité de former un anion chargé -1. Dans le réseau, six ions de chlorure entourent chaque ion sodium et vice versa. En raison de toutes les attractions électrostatiques entre les ions, la structure du réseau est très stable. Le nombre d'ions présents dans le réseau varie avec la taille. L'énergie du réseau ou l'enthalpie du réseau est la mesure de la force des liaisons ioniques dans le réseau. Normalement, l'enthalpie du réseau est exothermique.
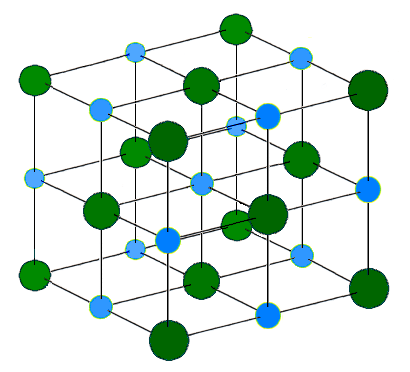
Figure 02: Structure du réseau de chlorure de sodium
Le diamant et le quartz sont deux exemples de réseaux covalents tridimensionnels. Le diamant est composé uniquement d'atomes de carbone, et chaque atome de carbone se lie de manière covalente à quatre autres atomes de carbone pour former la structure du réseau. Ainsi, chaque atome de carbone a l'agencement tétraédrique. Le diamant a une stabilité élevée en raison de cette structure. (Le diamant est l'un des minéraux les plus forts de la Terre.) Le quartz ou le dioxyde de silicium ont également des liaisons covalentes, mais ces liaisons existent entre les atomes de silicium et d'oxygène (réseau de différents atomes). Ces deux réseaux covalents ont un point de fusion très élevé, et ils ne peuvent pas conduire de l'électricité.
Quelle est la différence entre la molécule et le réseau?
Une molécule se forme lorsque deux atomes ou plus se lient entre eux via des liaisons chimiques covalentes ou des liaisons ioniques. D'un autre côté, un réseau se forme lorsqu'un grand nombre d'atomes, de molécules ou d'ions se lient entre eux pour former une structure de réseau régulière. Par conséquent, la principale différence entre la molécule et le réseau est que les molécules contiennent des atomes liés les uns aux autres tandis que les réseaux contiennent des atomes, des molécules ou des ions liés les uns aux autres.
Comme autre différence importante entre la molécule et le réseau, nous pouvons dire que la molécule peut se produire sous forme de solides, de liquides ou de gaz tandis que les réseaux ne se produisent que sous forme de substances solides. De plus, la masse d'une molécule est très faible par rapport à la masse d'un réseau car le nombre d'atomes dans un réseau est relativement très élevé.
Plus de différences sont montrées ci-dessous dans l'infographie de la différence entre la molécule et le réseau.
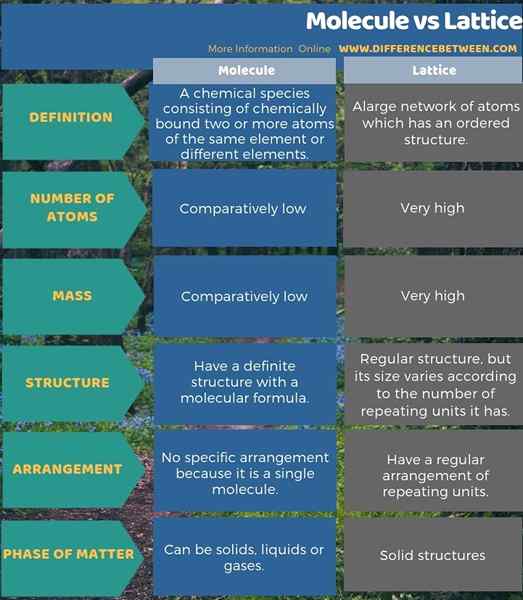
Résumé - Molécule vs réseau
Les molécules et les réseaux sont deux termes chimiques importants en chimie. Ils sont différents les uns des autres; Ainsi, nous ne pouvons pas les utiliser de manière interchangeable. La principale différence entre la molécule et le réseau est que les molécules contiennent des atomes liés les uns aux autres tandis que les réseaux contiennent des atomes, des molécules ou des ions liés les uns aux autres.
Référence:
1. LibreTexts. «Structures ioniques.”Chemistry LibreTexts, National Science Foundation, 19 juin 2017. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Qu'est-ce qu'une molécule?”Thoughtco, Jun. 11, 2018. Disponible ici
Image gracieuseté:
1.«Molecule d'eau 3D» par DBC334 (première version); Jynto (deuxième version) - Water-3D-VDW.PNG, (domaine public) via Commons Wikimedia
2.«Crystal chlorure de sodium» par H Padleckas (domaine public) via Commons Wikimedia


