Différence entre le système isolé et le système fermé
Le différence clé entre le système isolé et le système fermé est que Les systèmes isolés ne peuvent pas échanger à la fois la matière et l'énergie avec l'environnement mais, bien que les systèmes fermés ne puissent pas échanger la matière avec l'environnement, il peut échanger l'énergie.
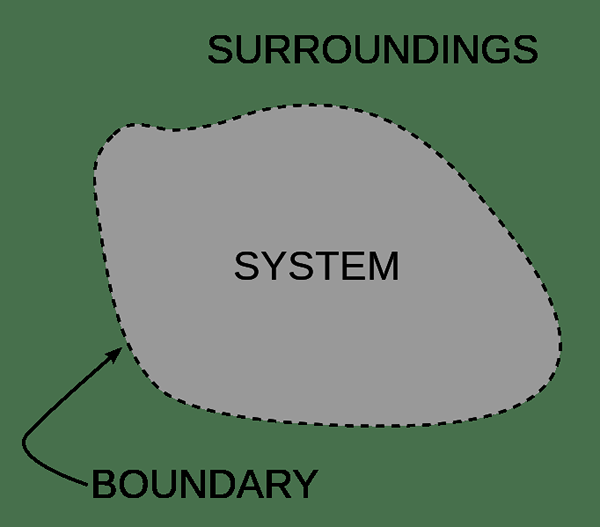
Pour la facilité de l'étude de la chimie, nous divisons l'univers en deux parties. La partie que nous allons étudier est le «système», et le reste est «l'environnement». Par exemple, un système peut être un organisme, un récipient de réaction ou même une seule cellule. Il y a une frontière entre un système et l'environnement. La frontière définit la portée du système. Parfois, la matière et l'échange d'énergie à travers ces frontières. De plus, nous pouvons classer un système en deux catégories; Ils sont le système ouvert et le système fermé. Un système isolé est une forme d'un système fermé.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le système isolé
3. Qu'est-ce que le système fermé
4. Comparaison côte à côte - Système isolé vs système fermé sous forme tabulaire
5. Résumé
Qu'est-ce que le système isolé?
Un système isolé est une forme d'un système fermé. Mais, il diffère d'un système fermé car il n'a ni contact mécanique ni thermique avec son environnement. Cela signifie; Les systèmes isolés ne peuvent pas échanger à la fois la matière et l'énergie avec les environs. De plus, ces systèmes atteignent l'équilibre thermodynamique avec le temps, en équilibrant la pression, la température ou d'autres paramètres.
Pratiquement, un système isolé n'existe pas parce que toutes les choses interagissent les unes avec les autres de certaines manières. Cependant, nous pouvons considérer l'univers entier comme un système isolé, étant donné qu'il n'y a pas de transfert de matière et d'énergie en dehors de l'univers. Théoriquement, cela est utile lors de la construction de modèles. Par exemple, les première et deuxième lois thermodynamiques décrivent un système isolé.
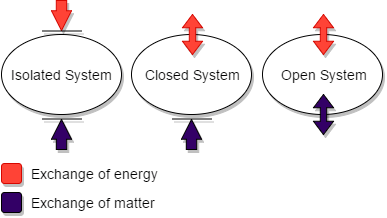
Figure 01: Comparaison du système isolé avec des systèmes ouverts et fermés
Le Première loi de la thermodynamique indique que «l'énergie interne d'un système isolé est constante." Le Deuxième loi de la thermodynamique dit que «l'entropie d'un système isolé augmente au cours d'un processus spontané."Cependant, cette loi n'est vraie que pour les systèmes isolés. L'entropie augmentera avec le temps dans un système isolé et atteindra la valeur maximale à l'équilibre. En bref, l'énergie globale de ces systèmes ne peut jamais augmenter. Ainsi, l'entropie ne peut jamais diminuer.
Qu'est-ce que le système fermé?
Dans un système fermé, la matière ne peut pas traverser la frontière. Par conséquent, l'affaire à l'intérieur d'un système fermé est toujours la même. Cependant, dans ce type de système, l'énergie échange avec l'environnement. Par exemple, lorsqu'une réaction se produit, le système peut se développer, ou il peut transférer l'énergie vers l'environnement s'il est à une température plus basse.

Figure 02: Un système et son environnement séparés par une frontière
Ex: Si nous couvrons le haut d'une tasse de thé chaude avec un couvercle, alors il devient un système fermé. Là, la vapeur ne peut pas échapper au système. De plus, les molécules de gaz dans l'environnement ne peuvent pas entrer dans le système. Par conséquent, il n'y a pas d'échange de matière. Cependant, la chaleur du thé échange avec les environs. Nous pouvons sentir la chaleur si nous touchons le couvercle de la tasse. Par conséquent, l'énergie sort en tant qu'énergie thermique. Là, le système atteint un équilibre avec l'environnement lorsque la température à l'intérieur et à l'extérieur du système devient égale.
Quelle est la différence entre le système isolé et le système fermé?
Une frontière sépare un système et ses environs. Nous pouvons nommer un système comme un système ouvert ou fermé en fonction de l'échange de matière et d'énergie à travers cette limite. Un système isolé est également une forme d'un système fermé. La principale différence entre le système isolé et le système fermé est que les systèmes isolés ne peuvent pas échanger à la fois la matière et l'énergie avec l'environnement mais, bien que les systèmes fermés ne puissent pas échanger la matière avec l'environnement, il peut échanger l'énergie.
Comme autre différence importante entre le système isolé et le système fermé, nous pouvons dire que l'entropie d'un système isolé ne peut jamais diminuer tandis que l'entropie d'un système fermé peut diminuer. De plus, les systèmes isolés sont théoriques; Cela signifie que ces systèmes n'existent pas dans la réalité. Cependant, les systèmes fermés existent dans la réalité.
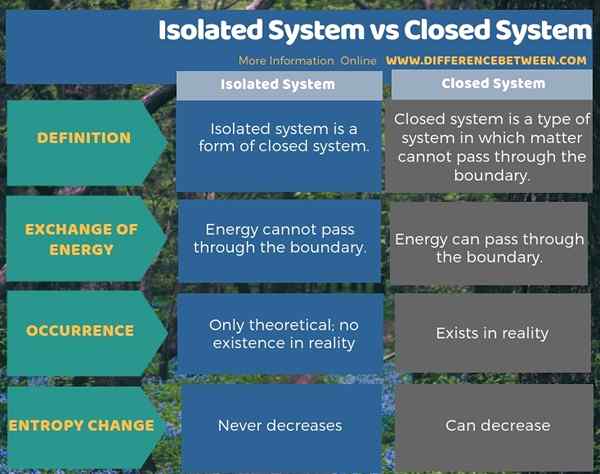
Résumé - Système isolé vs système fermé
Les systèmes sont de deux types; Ils sont le système ouvert et le système fermé. Les systèmes isolés sont également un type de système fermé. Cependant, il y a peu de différences entre eux. La principale différence entre le système isolé et le système fermé est que les systèmes isolés ne peuvent pas échanger à la fois la matière et l'énergie avec l'environnement mais, bien que les systèmes fermés ne puissent pas échanger la matière avec l'environnement, il peut échanger l'énergie.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition du système fermé (science).”Thoughtco, Jun. 22, 2018. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Définition du système isolé."Thoughtco, juil. 12, 2017. Disponible ici
Image gracieuseté:
1.«Systèmes de diagramme» par ALKH.Alwa - Propre travaux, (CC BY-SA 4.0) via Commons Wikimedia
2.«Boundaire du système» par Wavesmikey, (domaine public) via Commons Wikimedia


