Différence entre la théorie orbitale moléculaire et la théorie des liaisons de valence
Le différence clé entre la théorie orbitale moléculaire et la théorie des liaisons de valence est que La théorie orbitale moléculaire décrit la formation orbitale moléculaire, tandis que la théorie des liaisons de valence décrit les orbitales atomiques.
Différentes molécules ont des propriétés chimiques et physiques différentes que les atomes individuels qui se sont joints pour former ces molécules. Pour comprendre ces différences entre les propriétés atomiques et moléculaires, il est nécessaire de comprendre la formation de liaison chimique entre plusieurs atomes pour faire une molécule. À l'heure actuelle, nous utilisons deux théories mécaniques quantiques pour décrire la liaison covalente et la structure électronique des molécules. Ce sont la théorie des liaisons de valence et la théorie orbitale moléculaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la théorie orbitale moléculaire
3. Qu'est-ce que la théorie des liens de valence
4. Comparaison côte à côte - théorie orbitale moléculaire vs théorie des liaisons de valence sous forme tabulaire
5. Résumé
Qu'est-ce que la théorie orbitale moléculaire?
Dans les molécules, les électrons résident dans des orbitales moléculaires, mais leurs formes sont différentes, et elles sont associées à plus d'un noyaux atomiques. La théorie orbitale moléculaire est la description des molécules basées sur les orbitales moléculaires.
Nous pouvons obtenir la fonction d'onde décrivant une orbitale moléculaire par la combinaison linéaire d'orbitales atomiques. Une formes orbitales de liaison lorsque deux orbitales atomiques interagissent dans la même phase (interaction constructive). Lorsqu'ils interagissent hors phase (interaction destructrice), les orbitales anti-liaison de. Par conséquent, il existe des orbitales de liaison et anti-liaison pour chaque interaction suborbitale. Les orbitales de liaison ont une faible énergie, et les électrons sont plus susceptibles de résider dans ces. Les orbitales anti-liaison sont riches en énergie et lorsque toutes les orbitales de liaison sont remplies, les électrons vont et remplissent les orbitales anti-liaison.
Qu'est-ce que la théorie des liens de valence?
La théorie des liaisons de valence est basée sur une approche de liaison localisée, qui suppose que les électrons d'une molécule occupent les orbitales atomiques des atomes individuels. Par exemple, dans la formation du h2 molécule, deux atomes d'hydrogène chevauchent leurs orbitales 1. En chevauchant les deux orbitales, ils partagent une région commune dans l'espace. Initialement, lorsque les deux atomes sont éloignés, il n'y a pas d'interaction entre eux. Par conséquent, l'énergie potentielle est nulle.
Alors que les atomes s'approchent les uns des autres, chaque électron est attiré par le noyau de l'autre atome, et en même temps, les électrons se repoussent, tout comme les noyaux. Alors que les atomes sont toujours séparés, l'attraction est supérieure à la répulsion, donc l'énergie potentielle du système diminue. Le point auquel l'énergie potentielle atteint la valeur minimale, le système est à la stabilité. C'est ce qui se passe lorsque deux atomes d'hydrogène se réunissent et forment la molécule.

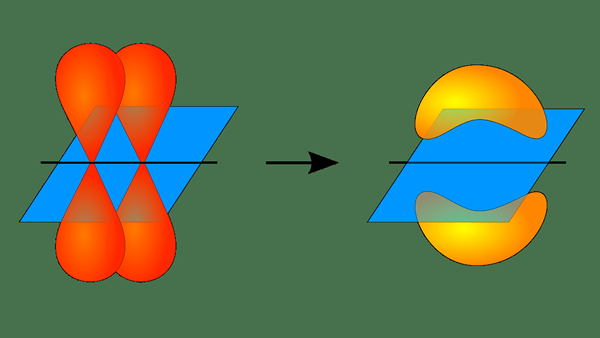
Figure 01: Formation d'une liaison Pi
Cependant, ce concept de chevauchement ne peut décrire que des molécules simples comme H2, F2, HF, etc. Cette théorie ne parvient pas à expliquer les molécules comme Ch4. Néanmoins, ce problème peut être résolu en combinant cette théorie avec la théorie orbitale hybride. L'hybridation est le mélange de deux orbitales atomiques non importantes. Par exemple, dans ch4, C a quatre SP hybrides3 orbitales se chevauchant avec les orbitales s de chaque h.
Quelle est la différence entre la théorie orbitale moléculaire et la théorie des liaisons de valence?
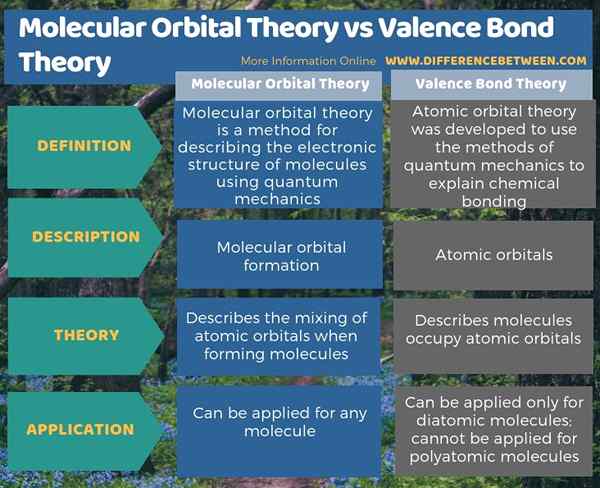
À l'heure actuelle, nous utilisons deux théories mécaniques quantiques pour décrire la liaison covalente et la structure électronique des molécules. Ce sont la théorie des liaisons de valence et la théorie orbitale moléculaire. La principale différence entre la théorie orbitale moléculaire et la théorie des liaisons de valence est que la théorie orbitale moléculaire décrit la formation orbitale moléculaire, tandis que la théorie de la liaison de valence décrit les orbitales atomiques. De plus, la théorie des liaisons de valence ne peut être appliquée que pour les molécules diatomiques, et non pour les molécules polyatomiques. Cependant, nous pouvons appliquer la théorie orbitale moléculaire pour toute molécule.
Résumé - Théorie orbitale moléculaire vs théorie des liaisons de valence
La théorie des liaisons de valence et la théorie orbitale moléculaire sont les deux théories mécaniques quantiques qui décrivent la liaison covalente et la structure électronique des molécules. La principale différence entre la théorie orbitale moléculaire et la théorie des liaisons de valence est que la théorie orbitale moléculaire décrit la formation orbitale moléculaire, tandis que la théorie de la liaison de valence décrit les orbitales atomiques.
Référence:
1. Helmenstine, Anne Marie. «Définition de la théorie de la liaison de la valence (VB)."Thoughtco, août. 4, 2019, disponible ici.
Image gracieuseté:
1. «Pi-Bond» par Pi-Bond.JPG: Jojanderrivative Work: Vladsinger (Talk) - Pi-Bond.JPG (CC BY-SA 3.0) via Commons Wikimedia


