Différence entre orbitale moléculaire et orbitale atomique

Le différence clé entre orbital moléculaire et orbital atomique est que Les orbitales atomiques décrivent les emplacements où la probabilité de trouver les électrons est élevée dans un atome tandis que les orbitales moléculaires décrivent les emplacements probables des électrons dans une molécule.
La liaison des molécules a été comprise d'une manière nouvelle avec les nouvelles théories présentées par Schrodinger, Heisenberg et Paul Dirac. Lorsque la mécanique quantique est entrée en scène avec leurs résultats, il a été découvert qu'un électron avait à la fois des propriétés de particules et d'ondes. Avec cela, Schrodinger a développé des équations pour trouver la nature d'onde d'un électron et a proposé l'équation d'onde et la fonction d'onde. La fonction d'onde (ψ) correspond à différents états pour l'électron.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une orbitale moléculaire
3. Qu'est-ce qu'une orbitale atomique
4. Comparaison côte à côte - orbitale moléculaire vs orbitale atomique sous forme tabulaire
5. Résumé
Qu'est-ce qu'une orbitale moléculaire?
Les atomes se réunissent pour former des molécules. Lorsque deux atomes se rapprochent pour former une molécule, les orbitales atomiques se chevauchent et se combinent pour devenir des orbitales moléculaires. Le nombre d'orbitales moléculaires nouvellement formées est égale au nombre d'orbitales atomiques combinés. De plus, l'orbital moléculaire entoure les deux noyaux des atomes, et les électrons peuvent se déplacer autour des deux noyaux. Semblable aux orbitales atomiques, les orbitales moléculaires contiennent au maximum 2 électrons, qui ont des tours opposés.
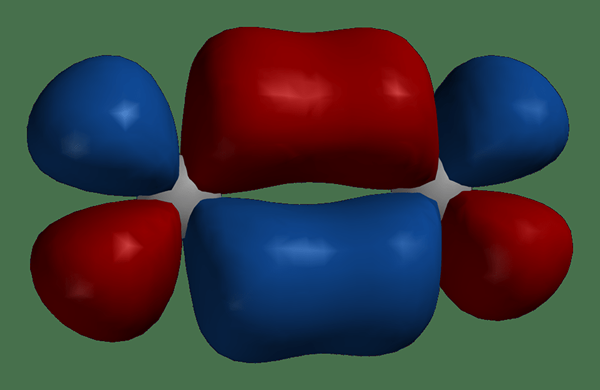
Figure 01: Orbitales moléculaires dans une molécule
De plus, il existe deux types d'orbitales moléculaires: les orbitales moléculaires de liaison et les orbitales moléculaires anti-aléatoires. Les orbitales moléculaires de liaison contiennent des électrons à l'état fondamental tandis que les orbitales moléculaires anti-adhérentes ne contiennent pas d'électrons à l'état fondamental. En outre, les électrons peuvent occuper des orbitales antibondantes si la molécule est à l'état excité.
Qu'est-ce qu'une orbitale atomique?
Max Born a souligné une signification physique au carré de la fonction d'onde (ψ2) après que Schrodinger ait mis en avant sa théorie. Selon Born, ψ2 exprime la probabilité de trouver un électron dans un emplacement particulier; Si ψ2 est une grande valeur, alors la probabilité de trouver l'électron dans cet espace est plus élevée. Par conséquent, dans l'espace, la densité de probabilité électronique est grande. Cependant, si le ψ2 est faible, alors la densité de probabilité électronique est faible. Les graphiques des axes ψ2 dans les axes x, y et z montrent ces probabilités, et elles prennent la forme des orbitales S, P, D et F. Nous appelons ces orbitales atomiques.

Figure 02: Différentes orbitales atomiques
De plus, nous définissons une orbitale atomique comme région d'espace où la probabilité de trouver un électron est grande dans un atome. Nous pouvons caractériser ces orbitales par des nombres quantiques, et chaque orbitale atomique peut accueillir deux électrons avec des tours opposés. Par exemple, lorsque nous écrivons la configuration d'électrons, nous l'écrivons comme 1S2, 2S2, 2P6, 3S2. 1, 2, 3… .n Les valeurs entières sont les nombres quantiques. L'écoute après le nom orbital montre le nombre d'électrons dans cette orbitale. Les orbitales S sont en forme de sphère et petites tandis que les orbitales p sont en forme d'haltères avec deux lobes. Ici, un lobe est positif tandis que l'autre lobe est négatif. De plus, l'endroit où deux lobes se touchent est le nœud. Il y a 3 orbitales p comme x, y et z. Ils sont disposés dans l'espace de telle manière que leurs axes sont perpendiculaires les uns aux autres.
Il y a cinq orbitales d et 7 orbitales F avec différentes formes. Par conséquent, les éléments suivants sont le nombre total d'électrons qui peuvent résider dans une orbitale.
- Electrons S orbital-2
- P orbitales - 6 électrons
- D orbitales - 10 électrons
- F orbitales - 14 électrons
Quelle est la différence entre l'orbite moléculaire et l'orbitale atomique?
La principale différence entre orbitale moléculaire et orbitale atomique est que les orbitales atomiques décrivent les emplacements où la probabilité de trouver les électrons est élevée dans un atome tandis que les orbitales moléculaires décrivent les emplacements probables des électrons dans une molécule. De plus, des orbitales atomiques sont présentes dans les atomes tandis que les orbitales moléculaires sont présentes dans les molécules. De plus, la combinaison d'orbitales atomiques entraîne la formation d'orbitales moléculaires. En outre, les orbitales atomiques sont nommées S, P, D et F alors qu'il existe deux types d'orbitales moléculaires comme des orbitales moléculaires de liaison et antibondante.
Résumé - Orbital moléculaire vs orbitale atomique
La principale différence entre orbitale moléculaire et orbitale atomique est que les orbitales atomiques décrivent les emplacements où la probabilité de trouver les électrons est élevée dans un atome tandis que les orbitales moléculaires décrivent les emplacements probables des électrons dans une molécule.
Référence:
1. Helmenstine, Anne Marie. «Définition orbitale et exemple."Thoughtco, mai. 7, 2019, disponible ici.
Image gracieuseté:
1. «Modèle de remplissage spatial d'une liaison Pi (orbitale moléculaire de liaison avec symétrie π) générée par le chevauchement de…» par Ben Mills (domaine public) via des fichiers de domaine public
2. «ATomic-orbital-Clouds SPD M0» par Geek3 - propre travail; Créé avec un nuage d'hydrogène dans le graphique Pythonthis PNG a été créé avec Python (CC BY-SA 4.0) via Commons Wikimedia


