Différence entre le chlorate et le perchlorate
Le différence clé entre le chlorate et le perchlorate Le chlorate est l'anion dérivé de la dissociation de l'acide chlorique tandis que le perchlorate est l'anion dérivé de la dissociation de l'acide perchlorique.
Le chlorate et le perchlorate sont des oxyanions contenant du chlore et des atomes d'oxygène. En général, ces termes sont également utilisés pour nommer respectivement les sels de chlorique et d'acide perchlorique. En d'autres termes, le terme chlorate peut se référer à tout composé contenant un chlorate anion avec un autre cation.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorate
3. Qu'est-ce que le perchlorate
4. Comparaison côte à côte - chlorate vs perchlorate sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorate?
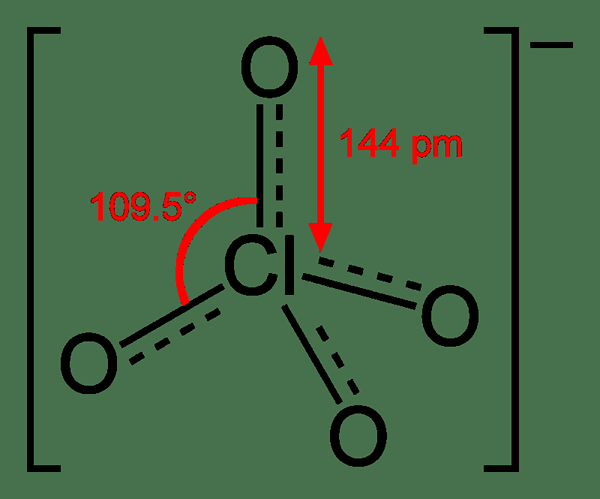
Le chlorate est un anion ayant la formule chimique CLO3-. L'état d'oxydation de l'atome de chorine est +5. Cependant, les composés chimiques contenant cet anion sont également nommés chlorates comme terme général. Cet anion est le sel de l'acide chorique. La structure de cet anion est la suivante:
La géométrie de cet anion est pyramidale trigonale. De plus, les composés contenant cet anion sont de forts oxydants. Par conséquent, nous devons les éloigner des matériaux facilement oxydés. Cet anion peut montrer une résonance; Par conséquent, la structure réelle du chlorate est une structure hybride, qui a toute la liaison CL-O avec la même longueur. De plus, l'atome de chlore ici est hypervalent. Cela signifie que l'atome de chlore a plus de huit électrons autour.
Lorsque vous envisagez la préparation, en laboratoire, nous pouvons produire des chlorates en ajoutant du chlore aux hydroxydes chauds, je.e. Koh. À l'échelle industrielle, nous pouvons le produire à partir de l'électrolyse du chlorure de sodium aqueux.
Qu'est-ce que le perchlorate?
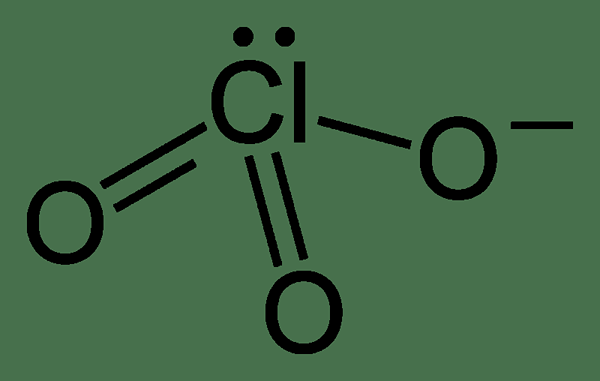
Le perchlorate est un anion ayant la formule chimique CLO4-. Il provient de l'acide perchlorique. En général, ce terme peut se référer à tout composé contenant un anion perchlorate. L'état d'oxydation de l'atome de chorine dans ce composé est +7. C'est la forme la moins réactive parmi les autres chlorates. La géométrie de cet ion est tétraédrique.

Surtout, les composés contenant cet anion existe sous forme de solides incolores qui sont solubles dans l'eau. Cet anion se forme lorsque les composés perchlorates se dissocient dans l'eau. À l'échelle industrielle, nous pouvons produire cet ion via la méthode d'électrolyse; Ici, l'oxydation du chlorate de sodium aqueux se produit.
Quelle est la différence entre le chlorate et le perchlorate?
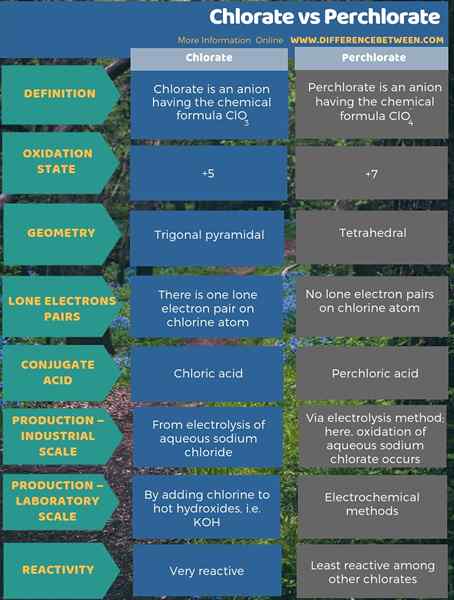
La principale différence entre le chlorate et le perchlorate est que le chlorate est l'anion dérivé de la dissociation de l'acide chlorique tandis que le perchlorate est l'anion dérivé de la dissociation de l'acide perchlorique. De plus, l'état d'oxydation de l'atome de chlore dans le chlorate est de +5 et l'état d'oxydation du perchlorate est +7. Lorsque l'on considère la géométrie de ces anions, l'anion chlorate a la géométrie pyramidale trigonale et l'anion perchlorate a une géométrie tétraédrique.
Résumé - Chlorate vs perchlorate
Le chlorate et le perchlorate sont essentiellement des oxyanions de chorine. La principale différence entre le chlorate et le perchlorate est que le chlorate est l'anion dérivé de la dissociation de l'acide chlorique tandis que le perchlorate est l'anion dérivé de la dissociation de l'acide perchlorique.
Référence:
1. "Chlorate.»Wikipedia, Wikimedia Foundation, 27 août. 2019, disponible ici.
Image gracieuseté:
1. «Chlorate-2d» par Benjah-Bmm27 - Propre travaux (domaine public) via Commons Wikimedia
2. «Perchlorate-2d-dimensions» par Benjah-Bmm27 - propre travail (domaine public) via Commons Wikimedia


