Différence entre masse molaire et masse moléculaire
Le différence clé entre la masse molaire et la masse moléculaire est que le La masse molaire donne la masse moyenne de la molécule tandis que la masse moléculaire donne la masse d'une seule molécule.
Les atomes peuvent se réunir dans diverses combinaisons pour former des molécules et d'autres composés. Les structures moléculaires donnent les rapports exacts des atomes; Ainsi, nous pouvons écrire des formules moléculaires pour les composés. Ceux-ci sont importants pour déterminer les masses moléculaires ou les masses molaires. Nous pouvons caractériser les molécules avec leurs masses. Savoir cela est vraiment utile dans les travaux de laboratoire lors de la mesure des composés pour les réactions.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la masse molaire
3. Qu'est-ce que la masse moléculaire
4. Comparaison côte à côte - masse molaire vs masse moléculaire sous forme tabulaire
5. Résumé
Qu'est-ce que la masse molaire?
Nous pouvons également appeler la masse molaire comme poids moléculaire. Ainsi, c'est la masse d'une substance pour une quantité donnée. L'unité SI pour la masse molaire est g mol-1. Cela donne la quantité d'atomes / molécules / composés présents dans une mole de substance. En d'autres termes, c'est la masse du nombre avogadro d'atomes / molécules ou composés.
Il est important de mesurer le poids des atomes et des molécules dans le scénario pratique. Mais il est difficile de les peser sous forme de particules individuelles, car leurs masses sont vraiment faibles selon les paramètres de pesage normaux (comme les grammes ou les kilogrammes). Par conséquent, pour combler cet écart et mesurer les particules dans un concept de masse molaire de niveau macroscopique est utile.

Figure 01: une molécule triatomique
La définition de la masse molaire est directement liée à l'isotope en carbone-12. La masse d'une mole d'atomes en carbone-12 est exactement 12 grammes, qui est sa masse molaire, elle est exactement 12 grammes par taupe. Nous pouvons calculer la masse molaire de molécules contenant le même atome comme O2 ou n2 en multipliant le nombre d'atomes par la masse molaire des atomes. De plus, nous pouvons calculer la masse molaire des composés comme NaCl ou Cuso4 en ajoutant les masses atomiques de chaque atome.
Qu'est-ce que la masse moléculaire?
La masse moléculaire d'un composé est la masse d'une molécule. Nous pouvons mesurer cela en utilisant des unités de masse atomique (AMU). 1 unité de masse atomique est la douzième de la masse d'un isotope C-12. Lorsque nous divisons la masse d'une molécule par la masse d'un douzième de la masse d'un isotope C-12, nous obtenons la masse relative. De plus, la masse moléculaire diffère selon les isotopes que la molécule contient. Lors du calcul de la masse moléculaire, nous devons considérer la masse isotopique pertinente.
Quelle est la différence entre la masse molaire et la masse moléculaire?
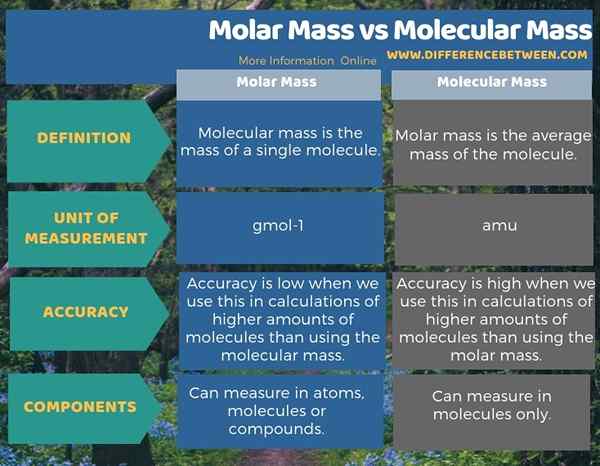
La masse moléculaire donne la masse d'une seule molécule (somme des masses atomiques dans la molécule), tandis que la masse molaire donne la masse moyenne de la molécule (masse du nombre avogadro de molécules). Par conséquent, c'est la principale différence entre la masse molaire et la masse moléculaire. Par conséquent, la masse moléculaire d'une molécule contenant des isotopes plus lourds peut être de quelques unités plus élevées que la masse molaire. Sinon, la valeur de la masse molaire et de la masse moléculaire est tout à fait la même pour une molécule similaire; Seules les unités sont différentes. Une différence significative entre la masse molaire et la masse moléculaire est que l'unité de la masse moléculaire est AMU, et l'unité de la masse molaire est gmol-1.
De plus, il est précis d'utiliser la masse moléculaire dans les calculs de quantités plus élevées de molécules que l'utilisation de la masse molaire. De plus, dans la mesure, une différence entre la masse molaire et la masse moléculaire est que la masse molaire est une mesure, que nous pouvons donner pour un atome, une molécule ou un composé. Mais nous ne pouvons déterminer la masse moléculaire que dans les molécules. S'il s'agit de la masse d'un atome, nous utilisons une terminologie différente; masse atomique.
L'infographie ci-dessous présente la différence entre la masse molaire et la masse moléculaire sous forme tabulaire.
Résumé - masse molaire vs masse moléculaire
La valeur de la masse molaire et de la masse moléculaire est tout à fait la même pour une molécule similaire. Mais, pour une molécule contenant des isotopes plus lourds, la masse moléculaire est plus élevée que la masse molaire. En résumé, la principale différence entre la masse molaire et la masse moléculaire est que la masse molaire donne la masse moyenne de la molécule tandis que la masse moléculaire donne la masse d'une seule molécule.
Référence:
1. "Masse moléculaire.»Wikipedia, Wikimedia Foundation, 26 septembre. 2018. Disponible ici
Image gracieuseté:
1.«Carbon-dioxyde-3d-vdw» par Jacek FH - propre travail (CC BY-SA 3.0) via Commons Wikimedia


