Différence entre MNO2 et CUO

Le différence clé Entre MNO2 et CUO est que MNO2 est l'oxyde de manganèse, tandis que Cuo est l'oxyde de cuivre.
MNO2 et CUO sont des composés inorganiques qui ont une apparence similaire, existant comme des solides brun noirâtre à température ambiante. Par conséquent, il est très difficile de distinguer ces deux composés solides simplement en les regardant, nous avons donc besoin de procédures expérimentales différentes pour les identifier séparément. En tant que différence fondamentale, ils ont différentes compositions chimiques; Le MNO2 a du manganèse sous sa forme d'oxyde tandis que le composé Cuo a du cuivre sous sa forme d'oxyde, qui a le cuivre dans un état d'oxydation +2.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que MNO2
3. Qu'est-ce que Cuo
4. Comparaison côte à côte - MNO2 vs Cuo sous forme tabulaire
5. Résumé
Qu'est-ce que MNO2?
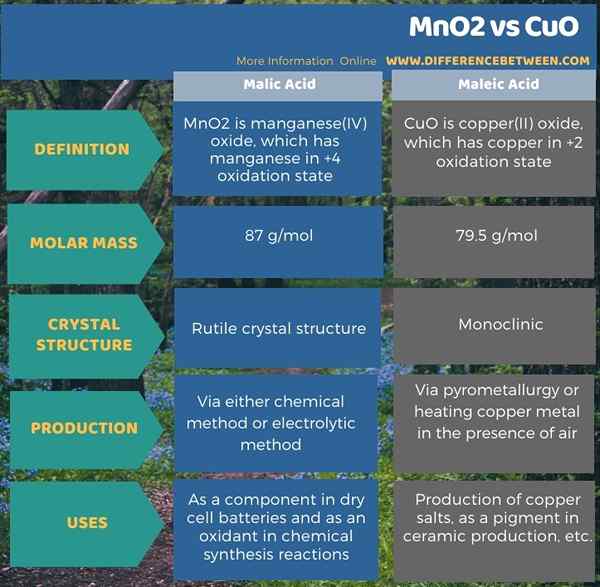
Le MNO2 est un oxyde de manganèse (IV) qui a du manganèse dans un état d'oxydation +4. Il apparaît comme un solide brun noirâtre à température ambiante. Naturellement, il se produit sous forme de pyrolusite minéral. Le nom IUPAC préféré pour ce composé est l'oxyde de manganèse (IV). La masse molaire de MNO2 est de 87 g / mol. C'est un solide insoluble dans l'eau. Il existe plusieurs applications de MNO2. Il est principalement utile comme composant dans les batteries de cellules sèches. Il est également important dans la synthèse organique en tant qu'oxydant.
Il existe plusieurs polymorphes connus et formes hydratées de MNO2. De plus, ce composé cristallise sous la forme d'une structure cristalline rutile. Il a un centre métal octaédrique et trois oxydes coordonnés.

Il existe deux méthodes de production possibles de dioxyde de manganèse (MNO2); Ils sont la méthode chimique et la méthode électrolytique. La méthode chimique commence par le dioxyde de manganèse naturel, qui a des impuretés. Nous devons convertir ce MNO2 naturel en nitrate de manganèse (II) à l'aide de tétroxyde de dinitrogen avec de l'eau. Lors du chauffage, le sel de nitrate s'évapore, libérant n2O4, Et nous pouvons observer le dioxyde de manganèse restant, qui est sous la forme pure. La méthode électrolytique est également une méthode utile dans la production de MNO2. Ici, pur dépôts de dioxyde de manganèse sur l'anode.
Qu'est-ce que Cuo?
Cuo est un oxyde de cuivre (II). Il a du cuivre dans un état d'oxydation +2. Il apparaît comme un solide brun noirâtre à température ambiante. C'est l'un des deux oxydes les plus stables de cuivre. Dans la nature, l'oxyde de cuivre se produit sous une forme minérale appelée téorite. Le nom IUPAC de ce composé est l'oxyde de cuivre (II). La masse molaire est de 79.5 g / mol. C'est insoluble dans l'eau. De plus, il a une structure cristalline monoclinique. Ici, un atome de cuivre s'associe à quatre atomes d'oxygène dans une géométrie à planaire carré.

La pyrométallurgie est la méthode que nous utilisons couramment pour la production de CUO. Ici, nous pouvons extraire l'oxyde de cuivre de son minerai. Dans ce processus, nous devons traiter le minerai avec un mélange de carbonate d'ammonium aqueux, d'ammoniac et d'oxygène. Ce traitement donne initialement des complexes de cuivre (I) et de cuivre (II). Ensuite, nous pouvons décomposer ces complexes afin d'obtenir du Cuo pur. De plus, nous pouvons produire ce composé via le chauffage en cuivre en présence d'oxygène également.
Quelles sont les similitudes entre MNO2 et CUO?
- MNO2 et CUO ont la même apparence de couleur brun noirâtre, et elles existent dans la phase solide à température ambiante.
- Ces composés sont insolubles dans l'eau.
Quelle est la différence entre MNO2 et CUO?
La principale différence entre MNO2 et CUO est que le MNO2 est l'oxyde de manganèse, tandis que Cuo est l'oxyde de cuivre. De plus, dans MNO2, l'atome métallique est dans un état d'oxydation +4, tandis qu'en CuO, l'atome métallique est dans un état d'oxydation +2.
De plus, une autre différence entre MNO2 et CUO est que MNO2 a une structure cristalline rutile, tandis que Cuo a une structure monoclinique.
Résumé - MNO2 vs CUO
MNO2 et CUO ont la même apparence de couleur brun noirâtre, et elles existent dans la phase solide à température ambiante. La principale différence entre MNO2 et CUO est que le MNO2 est l'oxyde de manganèse, tandis que Cuo est l'oxyde de cuivre.
Référence:
1. Helmenstine, Anne Marie. «Faits de manganèse."Thoughtco, juil. 3, 2019, disponible ici.
Image gracieuseté:
1. «Oxyde de manganèse (IV)» par Walkerma supposé - aucune source lisible par machine fournie. Propre travail assumé (basé sur les réclamations du droit d'auteur) (domaine public) via Commons Wikimedia
2. «Copperiioxide» par l'utilisateur Walkerma sur EN.Wikipedia, domaine public) via Commons Wikimedia


