Différence entre les défauts en excès de métal et défaut de déficience métallique
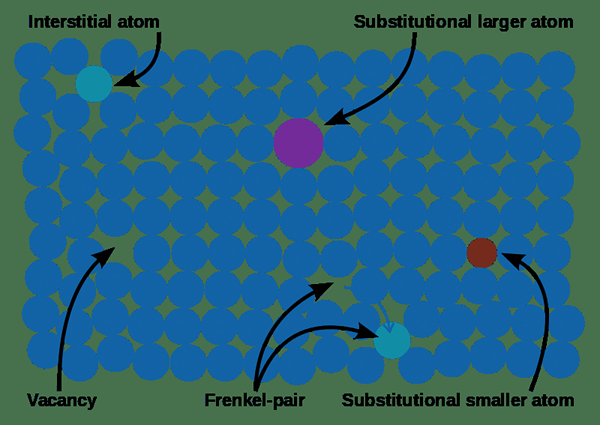
Le différence clé entre un défaut excès de métal et un défaut de déficience métallique est que Les défauts en excès de métal sont causés par des postes vacants anioniques et des cations supplémentaires dans les sites interstitiels tandis que le défaut de carence en métal est causé par des lacunes cationiques et des anions supplémentaires dans les sites interstitiels.
Défaut en excès de métal et défaut de déficience métallique sont deux types de défauts que nous pouvons observer dans les réseaux cristallins de certaines substances. Ces défauts surviennent en raison de la présence ou de l'absence de cations ou d'anions dans les réseaux cristallins.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le défaut excès en métal
3. Quel est le défaut de carence en métal
4. Comparaison côte à côte - défaut en excès de métal vs défaut de déficience en métal sous forme tabulaire
5. Résumé
Qu'est-ce que le défaut excès en métal?
Un défaut en excès de métal est un type de défaut de cristal qui se produit dans les réseaux cristallins. Soit une vacance anionique, soit un cation supplémentaire provoque ce défaut. En raison de la présence de ces défauts dans des solides inorganiques non stoichiométriques, ces solides contiennent des éléments constitutifs dans une ration non stoichiométrique.

Lorsque nous chauffons les halogénures métalliques alcalins qui sont placés dans une atmosphère contenant la vapeur du métal alcali, cela provoque la formation de postes vacants anions. Alors ces anions ont tendance à se diffuser à la surface du cristal et à se combiner avec des cations métalliques nouvellement générées. Ici, un électron est perdu de l'atome métallique, suivi de la diffusion de l'atome du cristal pour occuper le site de vacance anionique, formant un centre F à l'intérieur du cristal. Les centres F qui se forment dans le cristal peuvent donner différentes couleurs au réseau de cristal. E.g. chlorure de sodium - couleur jaune.
Il existe deux types différents de défauts en excès de métal:
- Défaut en excès de métal dû à la vacance anionique
Nous pouvons trouver ce type de défauts en excès de métal dans les halogénures alcalins tels que le chlorure de sodium et le chlorure de potassium. Ces défauts incluent la perte d'ions négatifs du site du réseau, qui laisse derrière lui un trou occupé par un électron afin de maintenir l'équilibre électrique du réseau cristallin. Ces électrons ont ensuite tendance à piéger dans les sites vacants anioniques du cristal.
- Défaut en excès de métal dû aux cations supplémentaires
Ce type de défauts en excès de métal se forme lors du chauffage des composés cristallins, où ils libèrent des cations supplémentaires. Ces cations ont tendance à occuper les sites interstitiels du réseau cristallin. Parallèlement à cette formation de cations, les électrons libérés (des cations) vont sur les sites interstitiels voisins. Un exemple de substance qui peut supporter ce type de défaut est le ZnO, l'oxyde de zinc.
Quel est le défaut de carence en métal?
Un défaut de déficience en métal est un type de défaut de cristal qui se produit dans des réseaux cristallins dans lesquels un poste de cation ou un anion supplémentaire provoque le défaut. Ce type de défauts métalliques peut être observé dans des complexes métalliques ayant une valence variable. Il existe deux types:
- Défaut de carence en métal due au vacance des cations
Dans ce type de défauts, un cation manque à son site de réseau; Par conséquent, la charge négative supplémentaire est équilibrée en obtenant deux charges positives au lieu d'une charge. Ces défauts se produisent principalement dans des composés ayant des états d'oxydation variables. E.g. oxyde de nickel.
- Défaut de carence en métal en raison de la présence de cations supplémentaires
Dans ces réseaux cristallins, les anions supplémentaires se produisent sur les sites interstitiels, et les ions adjacents sur un autre site interstitiel aident à maintenir la neutralité électrique du réseau. Ce type de très rare.
Quelle est la différence entre les défauts en excès de métal et le défaut de déficience métallique?
Défaut en excès de métal et défaut de déficience métallique sont deux types de défauts que nous pouvons observer dans les réseaux cristallins de certaines substances. La principale différence entre les défauts en excès de métal et le défaut de défailange métallique est que le défaut en excès de métal est causé par des lacunes anioniques et par des cations supplémentaires dans les sites interstitiels tandis que le défaut de carence en métal est causé par des vacancies cationiques et par des anions supplémentaires dans les sites interstitiels.
Vous trouverez ci-dessous une tabulation sommaire de la différence entre les défauts en excès de métal et le défaut de déficience métallique.

Résumé - Défaut en excès de métal vs défaut de déficience en métal
Des défauts métalliques surviennent en raison de la présence ou de l'absence de cations ou d'anions dans les réseaux cristallins. La principale différence entre les défauts de l'excès de métal et le défaut de défailange métallique est que le défaut excès de métal est causé par les lacunes anioniques et par les cations supplémentaires dans les sites interstitiels tandis que le défaut de déficience métallique est causé par les lacunes cationiques et par les anions supplémentaires dans les sites interstitiels.
Référence:
1.«Ce que les défauts excédentaires en métal expliquent avec exemple." ByJus, 23 novembre. 2020, disponible ici.
Image gracieuseté:
1. «Point Defects in Crystal Structures» par Daniferi - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


