Différence entre le réactif limitant et le réactif excédentaire
Le différence clé entre la limitation du réactif et l'excès de réactif est que Le réactif limitant peut limiter la quantité de produit final produit, tandis que l'excès de réactif n'a aucun effet sur la quantité de produit final.
Un réactif est un composé qui est consommé lors d'une réaction chimique. Une réaction chimique implique des réactifs - certains réactifs en excès et certains en quantités limitées. Le réactif limitant décide toujours de la quantité de produit final formé après l'achèvement de la réaction. Cela signifie que le réactif limitant limite la quantité de produit final, mais il n'y a pas un tel effet par l'excès de réactif.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qui limite le réactif
3. Qu'est-ce que l'excès de réactif
4. Comparaison côte à côte - réactif limitant vs réactif excédentaire sous forme tabulaire
5. Résumé
Qu'est-ce qui limite le réactif?
Le réactif limitant est le réactif d'une réaction chimique particulière qui peut limiter la formation du produit final. Par conséquent, il décide de la quantité de produits que nous pouvons produire de l'achèvement de la réaction chimique. De plus, ce réactif est complètement consommé pendant la réaction. La réaction s'arrête lorsque tout le réactif limitant est consommé. C'est parce que la réaction s'arrête lorsqu'un réactif est manquant.

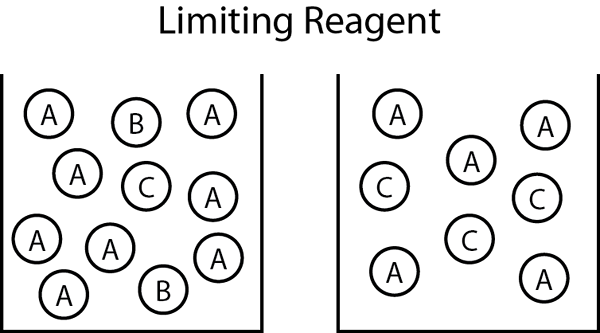
Figure 01: Si le réactif limitant est B, et le produit final est C tandis que l'excès de réactif est A, le mélange réactionnel final contient A et C.
En regardant la relation stoechiométrique entre ce réactif et le produit final dans une équation chimique, nous pouvons déterminer la quantité de produit qui va être formée.
Qu'est-ce que l'excès de réactif?
Un réactif en excès est le réactif qui est présent en excès dans un mélange réactionnel. Par conséquent, après l'achèvement de la réaction, une certaine quantité de ce réactif demeure car elle est en excès. Nous pouvons observer la présence d'un réactif en excès au début de la réaction, à la progression, et à la fin aussi. Parfois, la présence d'un réactif en excès est importante pour déterminer une quantité inconnue d'une substance particulière qui peut réagir avec cet excès de réactif. Par exemple, dans les méthodes titrimétriques, nous utilisons un réactif excédentaire avec une quantité connue et après la fin de la réaction. Ici, nous pouvons déterminer la quantité d'excès de réactif encore présent dans le mélange réactionnel, pour déterminer la quantité de réactive réagi avec l'inconnu.
Quelle est la différence entre le réactif limitant et le réactif excessif?
Le réactif limitant et l'excès de réactif sont importants dans une réaction chimique. La principale différence entre le réactif limitant et le réactif excédentaire est que le réactif limitant peut limiter la quantité de produit final produit, tandis que l'excès de réactif n'a aucun effet sur la quantité de produit final.
L'infographie ci-dessous montre plus de faits sur la différence entre la limitation du réactif et l'excès de réactif.
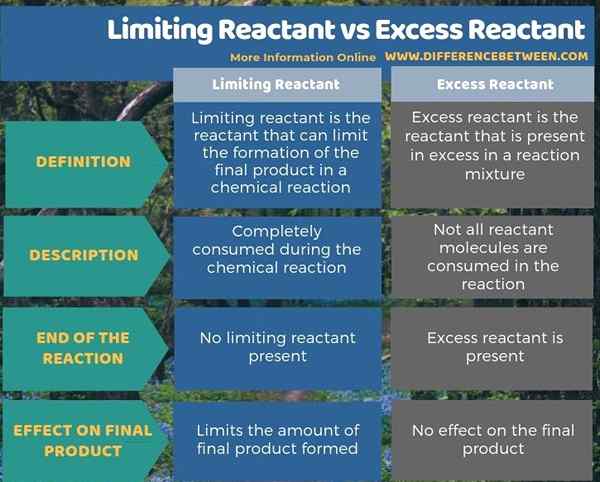
Résumé - Limiter réactif vs réactif excédentaire
Le réactif limitant et l'excès de réactif sont importants dans une réaction chimique. Un réactif limitant peut limiter la quantité de produit final produit, tandis que l'excès de réactif n'a aucun effet sur la quantité de produit final. Par conséquent, c'est la principale différence entre le réactif limitant et le réactif excessif
Référence:
1. «Excès et réactifs limitants." Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
Image gracieuseté:
1. «Limiter Reagent» par Brazosport College - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


