Différence entre les isotopes et les isomères

Isotopes vs isomères
Il existe des variations entre différents atomes. De plus, il existe des variations dans les mêmes éléments. Les isotopes sont des exemples de différences au sein d'un seul élément.
Une molécule ou un ion ayant la même formule moléculaire peut exister de différentes manières en fonction des ordres de liaison, des différences de distribution de charge, de la façon dont ils s'organisent dans l'espace, etc. Ceux-ci sont appelés isomères.
Isotopes
Les atomes du même élément peuvent être différents. Ces différents atomes du même élément sont appelés isotopes. Ils sont différents les uns des autres en ayant un nombre différent de neutrons. Étant donné que le nombre de neutrons est différent, leur nombre de masse diffère également. Cependant, les isotopes du même élément ont le même nombre de protons et de neutrons. Différents isotopes présents dans des quantités variables, et cela est donné en pourcentage de la valeur appelée abondance relative. Par exemple, l'hydrogène a trois isotopes comme protium, deutérium et tritium. Leur nombre de neutrons et d'abondances relatives sont les suivants.
1H - pas de neutrons, l'abondance relative est de 99.985%
2H- Un neutron, l'abondance relative est 0.015%
3H- Deux neutrons, l'abondance relative est de 0%
Le nombre de neutrons qu'un noyau peut tenir diffère d'un élément à l'autre. Parmi ces isotopes, seuls certains sont stables. Par exemple, l'oxygène a trois isotopes stables, et Tin a dix isotopes stables. La plupart du temps, les éléments simples ont le même numéro de neutrons que le nombre de protons mais, dans des éléments lourds, plus de neutrons sont là que les protons. Le nombre de neutrons est important pour équilibrer la stabilité des noyaux. Lorsque les noyaux sont trop lourds, ils deviennent instables et, par conséquent, ces isotopes deviennent radioactifs. Par exemple, 238 U émet des rayonnements et des cadres à des noyaux beaucoup plus petits. Les isotopes peuvent avoir des propriétés différentes en raison de leurs différentes masses. Par exemple, ils peuvent avoir des tours différents, donc leurs spectres RMN diffèrent. Cependant, leur nombre d'électrons est similaire en donnant lieu à un comportement chimique similaire.
Un spectromètre de masse peut être utilisé pour obtenir des informations sur les isotopes. Il donne le nombre d'isotopes qu'un élément a, leurs abondances et masses relatives.
Isomères
Les isomères sont des composés différents avec la même formule moléculaire. Il existe différents types d'isomères. Les isomères peuvent être principalement divisés en deux groupes en tant qu'isomères constitutionnels et isomères stéréo. Les isomères constitutionnels sont des isomères où la connectivité des atomes diffère en molécules. Le butane est l'alcane le plus simple pour montrer l'isomérisme constitutionnel. Butane a deux isomères constitutionnels, le butane lui-même et l'isobutène.
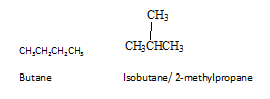
Dans les stéréo-isomères, les atomes sont connectés dans la même séquence, contrairement aux isomères constitutionnels. Les stéréoisomères ne diffèrent que par la disposition de leurs atomes dans l'espace. Les stéréoisomères peuvent être de deux types, énantiomères et diastéréomères. Les diastéréomères sont des stéréoisomères dont les molécules ne sont pas les images miroir les unes des autres. Les isomères trans de CIS du 1,2-dichloroéthène sont des diastéréomères. Les énantiomères sont des stéréoisomères dont les molécules sont des images miroir non superposables les unes des autres. Les énantiomères ne se produisent qu'avec des molécules chirales. Une molécule chirale est définie comme celle qui n'est pas identique à son image miroir. Par conséquent, la molécule chirale et son image miroir sont des énantiomères les uns des autres. Par exemple, la molécule de 2-butanol est chirale, et elle et ses images miroir sont des énantiomères.
| Quelle est la différence entre Isotopes et isomères? • Les isotopes sont des atomes différents du même élément. Les isomères sont des composés différents avec la même formule moléculaire. • Les isotopes diffèrent les uns des autres en raison du nombre de neutrons, tandis que les isomères diffèrent les uns des autres en raison de la disposition des atomes. • Les isotopes d'un seul élément ont le même comportement chimique, mais les propriétés physiques peuvent différer. Les isomères avec la même formule chimique ont des différences dans les propriétés chimiques et physiques (sauf certains isomères). |


