Différence entre les isotopes et les éléments
Le différence clé entre les isotopes et les éléments est que le Les isotopes sont des formes différentes du même élément chimique tandis que les éléments sont des espèces d'atomes ayant le même nombre de protons dans les noyaux atomiques.
Un type similaire d'atomes peut subir de légères modifications pour former différents isotopes. Un élément peut avoir plusieurs isotopes. La nature de chaque isotope contribue à la nature d'un élément. Ici, nous discuterons en détail des isotopes et des éléments afin d'élucider la différence entre les isotopes et les éléments.
CONTENU
1. Aperçu et différence clé
2. Que sont les isotopes
3. Que sont les éléments
4. Comparaison côte à côte - isotopes vs éléments sous forme tabulaire
5. Résumé
Que sont les isotopes?
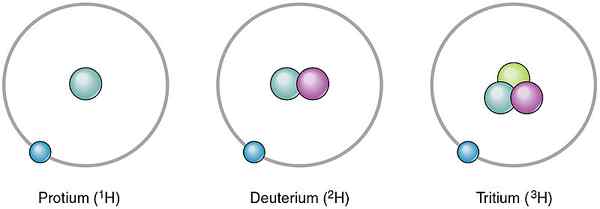
Les atomes du même élément peuvent être différents les uns des autres. Ces différents atomes du même élément sont des isotopes. Ils sont différents les uns des autres en ayant un nombre différent de neutrons. Étant donné que le nombre de neutrons est différent, leur nombre de masse diffère également. Cependant, les isotopes du même élément ont le même nombre de protons. Dans la nature, différents isotopes se produisent en quantités variables. Par conséquent, nous pouvons donner leur occurrence en pourcentage de la valeur appelée abondance relative. Par exemple, l'hydrogène a trois isotopes tels que Protium, Deuterium et Tritium. Le nombre de protons dans leurs noyaux atomiques est le même, mais le nombre de neutrons est différent. Leurs neutrons et abondances relatives sont les suivantes.
- 1H - pas de neutrons, l'abondance relative est de 99.985%
- 2H- Un neutron, l'abondance relative est 0.015%
- 3H- Deux neutrons, l'abondance relative est 0%

Figure 01: Isotopes de l'hydrogène
Le nombre de neutrons qu'un noyau peut tenir diffère d'un élément à l'autre. Parmi ces isotopes, seuls certains sont stables. Par exemple, l'oxygène a trois isotopes stables, et Tin a dix isotopes stables. La plupart du temps, les éléments simples ont le même numéro de neutrons que le numéro de proton. Mais dans des éléments lourds, plus de neutrons sont là que le nombre de protons.
De plus, le nombre de neutrons est important pour équilibrer la stabilité des noyaux. Lorsque les noyaux sont trop lourds, ils deviennent instables et par conséquent, ces isotopes deviennent radioactifs. Par exemple, 238U émet un rayonnement et se désintègre en noyaux beaucoup plus petits. Les isotopes peuvent avoir des propriétés différentes en raison de leurs différentes masses. Par exemple, ils peuvent avoir des tours différents. Ainsi, leurs spectres RMN diffèrent. Cependant, leur nombre d'électrons est similaire en donnant lieu à un comportement chimique similaire.
Que sont les éléments?
Nous connaissons le mot «élément», car nous les apprenons dans le tableau périodique. Il y a environ 118 éléments chimiques dans le tableau périodique, et ils sont disposés en fonction de leur numéro atomique. Un élément est une espèce chimique, qui ne représente qu'un seul type d'atomes. Par conséquent, ils sont purs. De plus, les atomes du même élément ont le même nombre de protons dans leurs noyaux atomiques. Mais, le nombre de neutrons peut différer les uns des autres. Par exemple, le plus petit élément est l'hydrogène. L'argent, l'or, le platine sont quelques-uns des éléments précieux communément connus.
Chaque élément a une masse atomique, un numéro atomique, un symbole, une configuration électronique, etc. Bien que la plupart des éléments se produisent naturellement, il existe des éléments synthétiques comme Californium, Americium, Einsteinium et Mendelevium. Nous pouvons classer tous les éléments en trois groupes; En tant que métaux, métalloïdes et non-métaux.
Figure 02: Endosquelette
De plus, nous pouvons les classer en groupes et périodes en fonction de caractéristiques plus spécifiques. De plus, les éléments du même groupe ou de la même période partagent certaines caractéristiques communes, et certaines propriétés peuvent changer séquentiellement lorsque vous passez par un groupe ou une période. De plus, les éléments peuvent subir des changements chimiques pour former divers composés; Cependant, nous ne pouvons pas décomposer les éléments davantage par de simples méthodes chimiques.
Quelle est la différence entre les isotopes et les éléments?
Le terme élément chimique décrit une espèce d'atomes tandis que le terme isotopes décrit différentes formes du même élément chimique. Par conséquent, la principale différence entre les isotopes et les éléments est que les isotopes sont des formes différentes du même élément chimique tandis que les éléments sont des espèces d'atomes ayant le même nombre de protons dans les noyaux atomiques. De plus, une autre différence entre les isotopes et les éléments est que les isotopes ont un nombre différent de neutrons, mais les éléments chimiques peuvent avoir soit le même nombre de neutrons, soit un nombre différent de neutrons; Mais ils n'ont jamais le même nombre de protons.
Comme autre différence importante entre les isotopes et les éléments, nous pouvons dire que la masse atomique d'un isotope peut être calculée en ajoutant simplement la masse totale de protons et les neutrons dans les noyaux atomiques alors que nous pouvons calculer la masse atomique d'un élément chimique en utilisant l'atomique masses de ses isotopes et leur abondance relative.

Résumé - Isotopes vs éléments
Les isotopes sont des formes atomiques différentes du même élément chimique. La principale différence entre les isotopes et les éléments est que les isotopes sont des formes différentes du même élément chimique tandis que les éléments sont des espèces d'atomes ayant le même nombre de protons dans les noyaux atomiques.
Référence:
1. «Élément chimique.»Wikipedia, Wikimedia Foundation, 11 novembre. 2018. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Définition des isotopes et exemples en chimie.”Thoughtco, oct. 22, 2018. Disponible ici
Image gracieuseté:
1."204 isotopes de l'hydrogène-01" par OpenStax College - Anatomy & Physiology, Connexions Web Site. (CC par 3.0) via Commons Wikimedia
2.«Tableau périodique simple-Enf-en» par offnfopt - propre travail, (domaine public) via Commons Wikimedia


