Différence entre les formules empiriques et moléculaires
Le différence clé entre les formules empiriques et moléculaires est qu'un La formule empirique ne donne que le rapport le plus simple des atomes alors qu'une formule moléculaire donne le nombre exact de chaque atome dans une molécule.
En chimie, nous utilisons souvent des symboles pour identifier les éléments et les molécules. La formule moléculaire et la formule empirique sont deux de ces méthodes symboliques que nous utilisons pour représenter les molécules et les composés d'une manière facile.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les formules empiriques
3. Quelles sont les formules moléculaires
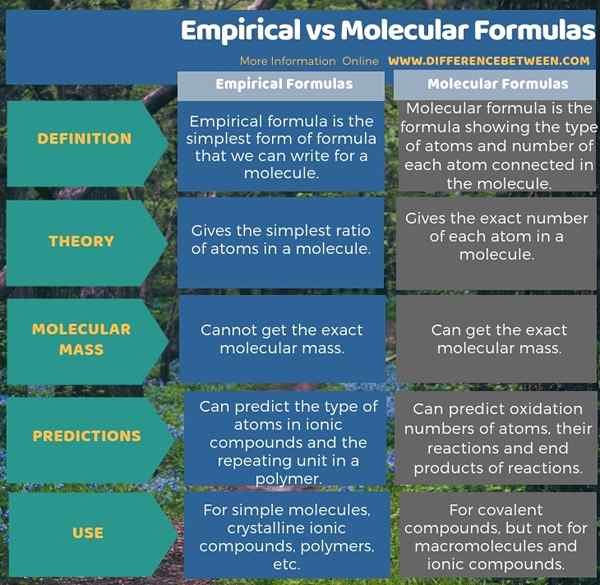
4. Comparaison côte à côte - formules moléculaires empiriques vs sous forme tabulaire
5. Résumé
Quelles sont les formules empiriques?
Les formules empiriques sont la forme la plus simple de formules que nous pouvons écrire pour une molécule. Il montre le type d'atomes dans la molécule, mais il ne donne pas le nombre réel de chaque atome. Il donne plutôt le rapport entier le plus simple de chaque atome de la molécule.
Par exemple, C6H12O6 est la formule moléculaire du glucose et ch2O est sa formule empirique. Surtout, nous donnons des formules empiriques pour les composés ioniques, qui sont sous la forme cristalline. Par exemple, nous ne pouvons pas dire le nombre exact de Na et Cl dans un cristal NaCl. Nous écrivons donc simplement la formule empirique indiquant le rapport des atomes connectés.
Vidéo 01: formule empirique
De plus, CA3(Po4)2 est également une formule empirique. Dans un composé ionique, nous pouvons facilement écrire la formule en échangeant les charges de chaque ion, et qui donne automatiquement le nombre de chaque ion dans la molécule. De plus, nous pouvons écrire des formules empiriques pour les macromolécules. Lorsque nous écrivons des formules empiriques pour les polymères, nous écrivons l'unité de répétition, puis nous utilisons la lettre «N» pour dire qu'il ne peut y avoir n nombre d'unités répétitives dans le polymère. Cependant, nous ne pouvons pas utiliser la formule empirique pour trouver la masse, la structure ou les isomères d'une molécule, mais il est utile à des fins analytiques.
Quelles sont les formules moléculaires?
Les formules moléculaires sont les formules montrant le type d'atomes et le nombre de chaque atome connecté dans la molécule. Par conséquent, il donne la stoechiométrie correcte de chaque atome. Les atomes sont représentés par leurs symboles, qui sont indiqués dans le tableau périodique. De plus, nous devons écrire le nombre d'atomes comme indices. Certaines formules moléculaires sont neutres (pas de charge), mais s'il y a une charge, nous pouvons le montrer sur le côté droit en exposant.
Nous utilisons normalement la formule moléculaire dans les réactions chimiques, ou lorsque nous documentons des détails chimiques. En regardant simplement la formule moléculaire, nous pouvons obtenir beaucoup d'informations sur la molécule. Par exemple, nous pouvons calculer la masse moléculaire. De plus, s'il s'agit d'un composé ionique, nous pouvons prédire quels sont les ions et combien d'entre eux seront libérés lorsqu'il sera dissous dans l'eau.
Vidéo 02: Comparaison des formules moléculaires et empiriques
De plus, nous pouvons prédire les nombres d'oxydation de chaque atome, comment ils vont réagir dans une réaction et les produits résultants en utilisant des formules moléculaires. Cependant, à partir de la formule moléculaire uniquement, nous ne pouvons pas prédire la disposition moléculaire exacte. Parce que parfois il existe plusieurs formules structurelles pour une seule formule moléculaire. Ce sont les «isomères». Les isomères ont la même formule moléculaire mais peuvent différer de la connectivité des atomes (isomères constitutionnels) ou de la disposition spatiale des atomes (stéréoisomères). Ainsi, en regardant la formule moléculaire, nous pouvons écrire tous les isomères possibles pour une molécule.
Quelle est la différence entre les formules empiriques et moléculaires?
Les formules empiriques sont la forme la plus simple de formules que nous pouvons écrire pour une molécule tandis que les formules moléculaires sont les formules montrant le type d'atomes et le nombre de chaque atome connecté dans la molécule. Par conséquent, la principale différence entre les formules empiriques et moléculaires est que la formule empirique ne donne que le rapport le plus simple de l'atome tandis que la formule moléculaire donne le nombre exact de chaque atome dans une molécule. De plus, nous ne pouvons pas calculer la masse moléculaire exacte en utilisant la formule empirique tandis que nous pouvons obtenir la masse moléculaire exacte en utilisant la formule moléculaire.
Comme autre différence importante entre les formules empiriques et moléculaires, nous pouvons dire que nous pouvons prédire le type d'atomes dans les composés ioniques et l'unité de répétition dans un polymère alors que nous pouvons prédire les nombres d'oxydation de chaque atome, comment ils vont réagir dans une réaction et les produits résultants en utilisant des formules moléculaires.

Résumé - Formules empiriques vs moléculaires
Pour une certaine molécule ou une macromolécule, nous pouvons écrire une formule empirique. Cependant, la formule moléculaire est la forme la plus détaillée. La principale différence entre les formules empiriques et moléculaires est qu'une formule empirique ne donne que le rapport le plus simple de l'atome alors qu'une formule moléculaire donne le nombre exact de chaque atome dans une molécule.
Référence:
1. «Formule empirique 2.»Métaux de transition. Disponible ici
2. LibreTexts. «6.9: Calcul des formules moléculaires pour les composés.”Chemistry LibreTexts, National Science Foundation, 20 mai 2018. Disponible ici
Vidéo gracieuseté:
1."75649220" par elearn.Punjab via Vimeo
2.”34647886" par Dick Trent via Vimeo