Différence entre le peroxyde d'hydrogène et le peroxyde de benzoyle
Le différence clé entre le peroxyde d'hydrogène et le peroxyde de benzoyle est que le Le peroxyde d'hydrogène est soluble dans l'eau tandis que le peroxyde de benzoyle est insoluble dans l'eau.
Le peroxyde d'hydrogène et le peroxyde de benzoyle ont des noms quelque peu similaires et des groupes fonctionnels similaires, mais ils se comportent différemment. Outre la différence clé ci-dessus entre le peroxyde d'hydrogène et le peroxyde de benzoyle, une autre différence majeure entre les deux composés est que le peroxyde d'hydrogène est un composé inorganique tandis que le peroxyde de benzoyle est un composé organique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le peroxyde d'hydrogène
3. Qu'est-ce que le peroxyde de benzoyle
4. Comparaison côte à côte - peroxyde d'hydrogène vs peroxyde de benzoyle sous forme tabulaire
5. Résumé
Qu'est-ce que le peroxyde d'hydrogène?
Le peroxyde d'hydrogène est un composé inorganique ayant la formule chimique H2O2. Quand il est pur, il a une couleur bleu pâle, et c'est un liquide clair. De plus, ce liquide est légèrement plus visqueux que l'eau. Il s'agit également du peroxyde le plus simple parmi tous les composés de peroxyde.
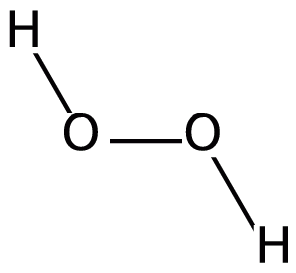
Figure 01: Structure du peroxyde d'hydrogène
Parmi l'application du peroxyde d'hydrogène, les principales applications comprennent l'utiliser comme oxydant, agent de blanchiment et comme antiseptique. Il existe une liaison de peroxyde instable entre deux atomes d'oxygène dans ce composé; Ainsi, le composé est très réactif. Par conséquent, il se décompose lentement lorsqu'il est exposé à la lumière. De plus, nous devons stocker ce composé avec un stabilisateur dans une solution faiblement acide.
La masse molaire de peroxyde d'hydrogène est 34.014 g / mol. Le peroxyde d'hydrogène a une odeur légèrement pointue. Le point de fusion est −0.43 ° C, et le point d'ébullition est 150.2 ° C. Cependant, si nous faisons bouillir du peroxyde d'hydrogène à ce point d'ébullition, il subit pratiquement une décomposition thermique explosive. De plus, ce composé est miscible avec de l'eau car il peut former des liaisons hydrogène. Là, il forme un mélange eutectique avec de l'eau (un mélange homogène qui fond ou se solidifie à une seule température). Ce mélange montre une dépression de point de congélation.
Qu'est-ce que le peroxyde de benzoyle?
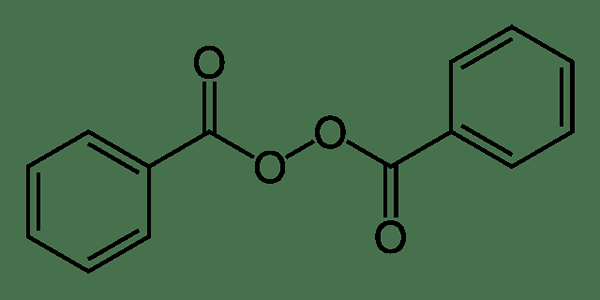
Le peroxyde de benzoyle est un composé organique ayant la formule chimique C14HdixO4. Il existe deux principales applications de ce composé; comme médicament et en tant que produit chimique industriel. La masse molaire est 242.33 g / mol. Il a un point de fusion dans la plage de 103 à 105 ° C. Cependant, il a tendance à subir une décomposition. Il est insoluble dans l'eau car il ne peut pas former des liaisons hydrogène avec des molécules d'eau.

Figure 02: Structure du peroxyde de benzoyle
Ce composé est un ingrédient majeur des médicaments et des cosmétiques que nous utilisons pour traiter l'acné. Nous l'utilisons pour traiter les conditions d'acné légères ou modérées. En dehors de cela, nous utilisons ce composé comme de la farine de blanchiment, à des fins de blanchiment de cheveux, de blanchiment des dents, de fins de blanchiment textile, etc. Il y a certains effets secondaires de l'utilisation du peroxyde de benzoyle comme l'irritation cutanée, la sécheresse, le pelage, etc.
Quelle est la différence entre le peroxyde d'hydrogène et le peroxyde de benzoyle?
Le peroxyde d'hydrogène et le peroxyde de benzoyle sont deux composés chimiques contenant des groupes de peroxyde. La principale différence entre le peroxyde d'hydrogène et le peroxyde de benzoyle est que le peroxyde d'hydrogène est soluble à l'eau mais le peroxyde de benzoyle est insoluble dans l'eau. De plus, le peroxyde d'hydrogène est un composé inorganique tandis que le peroxyde de benzoyle est un composé organique.
Une autre différence importante entre le peroxyde d'hydrogène et le peroxyde de benzoyle est, le peroxyde d'hydrogène peut former des liaisons hydrogène en raison de la présence de groupes -OH mais, le peroxyde de benzoyle ne peut pas former des liaisons hydrogène car il n'y a pas de groupes -OH ou d'autres groupes formant des liaisons hydrogène.
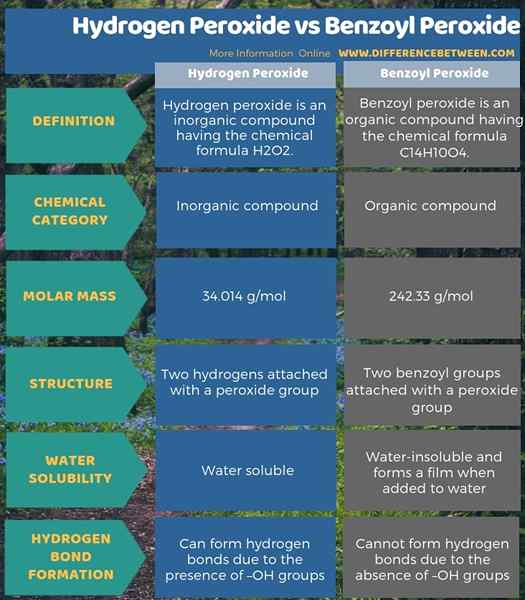
Résumé - peroxyde d'hydrogène vs peroxyde de benzoyle
Le peroxyde d'hydrogène et le peroxyde de benzoyle sont des composés de peroxyde mais sont différents les uns des autres. La principale différence entre le peroxyde d'hydrogène et le peroxyde de benzoyle est que le peroxyde d'hydrogène est soluble à l'eau tandis que le peroxyde de benzoyle est insoluble dans l'eau.
Référence:
1. M. Mikhail, t. Young, en décontamination dans les hôpitaux et les soins de santé, 2014
2. "Peroxyde d'hydrogène.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.«Peroxyde d'hydrogène» sans auteur lisible par machine fourni. (CC par 2.0) via Commons Wikimedia
2.«Benzoyl-peroxyde» par Bryan Derksen - Propre travaux, (domaine public) via Commons Wikimedia


