Différence entre la fission homolytique et hétérolytique
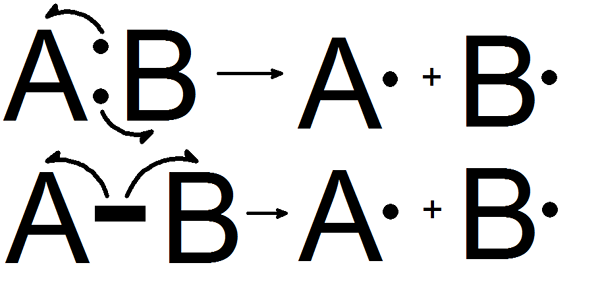
Le différence clé entre la fission homolytique et hétérolytique est que le La fission homolytique donne un électron à une liaison à chaque fragment tandis que la fission hétérolytique donne deux électrons de liaison à un fragment et aucun des électrons de liaison à l'autre fragment.
La fission est la destruction d'une liaison chimique covalente. En d'autres termes, il divise une molécule en deux fractions. La fission se présente sous deux formes comme une fission homolytique qui forme deux fractions égales et fission hétérolytique qui forme deux fractions inégales.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la fission homolytique
3. Qu'est-ce que la fission hétérolytique
4. Comparaison côte à côte - Fission homolytique vs hétérolytique sous forme tabulaire
5. Résumé
Qu'est-ce que la fission homolytique?
La fission homolytique est la dissociation d'une liaison chimique et formant deux fragments égaux. Une liaison chimique (liaison covalente) contient deux électrons. Dans cette forme de fission, chacun des fragments obtient un électron non apparié. Lorsque cette dissociation de liaison se produit dans une molécule neutre qui a un nombre égal d'électrons, il forme deux radicaux libres égaux.
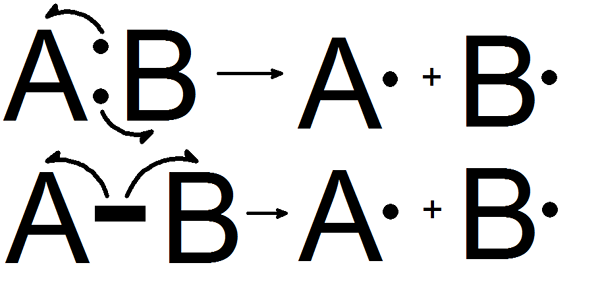
Figure 01: Fission homolytique
L'énergie de dissociation des liaisons homolytiques fait référence à l'énergie qui est absorbée ou libérée pendant ce processus. Cependant, cette fission n'a lieu que dans des conditions spécifiques;
- Le rayonnement UV
- Chaleur
En plus de cela, certaines liaisons chimiques telles que la liaison de peroxyde sont suffisamment faibles pour se dissocier spontanément sur une légère chaleur.
Qu'est-ce que la fission hétérolytique?
La fission hétérolytique est la dissociation d'une liaison chimique et formant deux fragments inégaux. Une liaison chimique (liaison covalente) contient deux électrons. Dans cette forme de fission, un fragment obtient les deux paires d'électrons de liaison tandis que d'autres fragments n'obtient aucun des électrons de liaison.
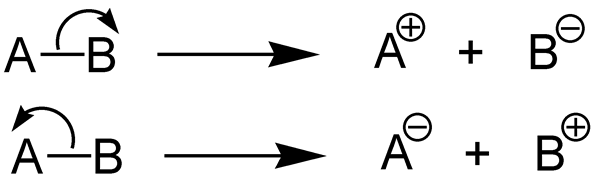
Figure 02: Fission hétérolytique
Le fragment qui obtient les deux électrons de liaison forment un anion. L'autre fragment forme un cation. Là, le fragment qui obtient les deux électrons est plus électronégatif que l'autre fragment. Cette fission se produit dans des liaisons covalentes uniques. L'énergie qui est absorbée ou libérée pendant ce clivage de liaison est appelée «énergie hétérolytique de dissociation des liaisons».
Quelle est la différence entre la fission homolytique et hétérolytique?
La fission homolytique est la dissociation d'une liaison chimique et formant deux fragments égaux. Il donne un électron à un lien à chaque fragment. L'énergie qui est absorbée ou libérée pendant la fission homolytique est appelée «énergie de dissociation des liaisons homolytiques». La fission hétérolytique est la dissociation d'une liaison chimique et formant deux fragments inégaux. Il donne deux électrons de liaison à un fragment et aucun des électrons de liaison à l'autre fragment. C'est la principale différence entre la fission homolytique et hétérolytique. L'énergie qui est absorbée ou libérée pendant la fission hétérolytique est appelée «énergie de dissociation des liaisons hétérolytiques».
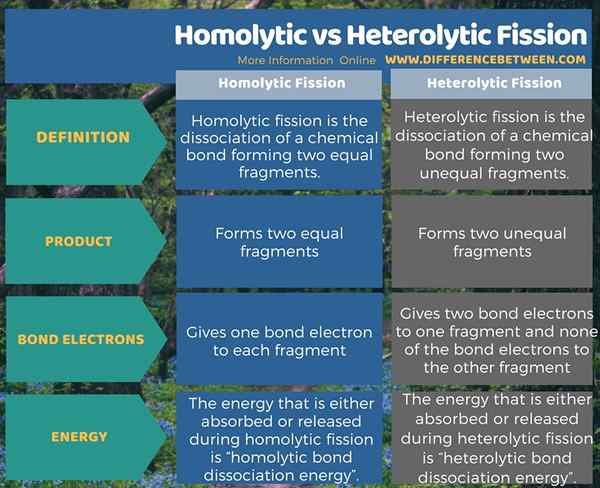
Résumé - Fission homolytique vs hétérolytique
La fission est une dissociation des liaisons. Il est sous deux formes comme une fission homolytique et hétérolytique. La différence entre la fission homolytique et hétérolytique est que la fission homolytique donne un électron de liaison à chaque fragment tandis que la fission hétérolytique donne deux électrons de liaison à un fragment et aucun des électrons de liaison à l'autre fragment.
Référence:
1. «Homolyse (chimie).»Wikipedia, Wikimedia Foundation, 17 juillet 2018. Disponible ici
2. «Activateur enzymatique.»Wikipedia, Wikimedia Foundation, 15 juillet 2018. Disponible ici
Image gracieuseté:
1.'Arrow poussant Homolytic'By Shoy - Propre travaux, (domaine public) via Commons Wikimedia
2.'Hétérolyse (chimie)' par Jürgen Martens - Jürgen Martens, (CC By-Sa 3.0) via Commons Wikimedia


