Différence entre la chaleur de formation et la chaleur de réaction
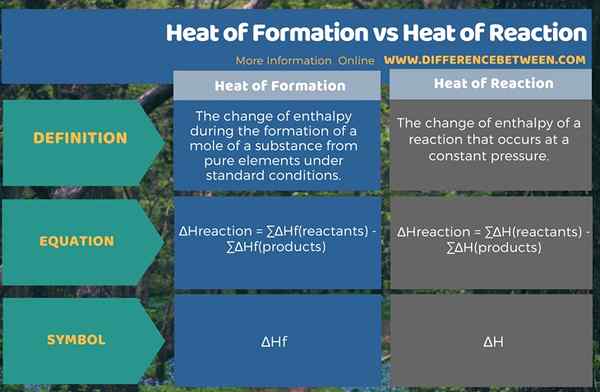
Le différence clé entre la chaleur de formation et la chaleur de réaction est que le La chaleur de formation est le changement d'enthalpie pendant la formation d'une taupe d'une substance dans des conditions standard tandis que la chaleur de réaction est le changement d'enthalpie lors d'une réaction chimique qui se produit à une pression constante.
La chaleur de formation et la chaleur de réaction sont des valeurs d'enthalpie importantes concernant les réactions chimiques. Nous définissons ces termes pour des conditions standard, je.e. pression standard et température standard. Ici, la chaleur ou l'enthalpie est l'énergie qui libère un système ou absorbé par un système pendant la réaction chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la chaleur de formation
3. Qu'est-ce que la chaleur de réaction
4. Comparaison côte à côte - chaleur de formation vs chaleur de réaction sous forme tabulaire
5. Résumé
Qu'est-ce que la chaleur de formation?
La chaleur de formation est le changement d'enthalpie pendant la formation d'une mole de substance à partir d'éléments purs dans des conditions standard. Ici, les conditions standard sont une pression de 1 atm et 298.15 température de Kelvin. Puisque nous considérons la formation d'une taupe, l'unité de cette énergie est KJ / mol. Cette énergie est soit l'énergie que la réaction de formation libère, soit l'énergie que la réaction consomme pendant la progression. L'équation de cette enthalpie est la suivante;

Ici, ∆ est un symbole, qui indique un changement d'enthalpie, H est la quantité d'énergie et F indique une réaction de formation. Dans cette réaction, tous les constituants sont dans des conditions standard, sinon, ce n'est pas la chaleur de formation. Par exemple, la formation de dioxyde de carbone est la suivante.
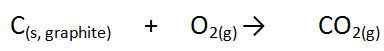
La forme élémentaire pure de carbone est du graphite et la source d'oxygène est une molécule d'oxygène diatomique. Lorsque nous faisons cette réaction de formation dans des conditions standard et mesurons le changement d'enthalpie, nous l'appelons la chaleur de formation.
Qu'est-ce que la chaleur de réaction?
La chaleur de réaction est le changement d'enthalpie d'une réaction qui se produit à une pression constante. Nous mesurons cette différence d'énergie dans l'unité de KJ / MOL. Il donne l'énergie qui est libérée ou absorbée lors d'une réaction chimique. Le symbole de ce changement d'enthalpie est ∆H. Si la valeur est une valeur positive, nous l'appelons une réaction endothermique. Si la valeur est négative, nous l'appelons une réaction exothermique. L'équation de ce changement d'enthalpie est la suivante;
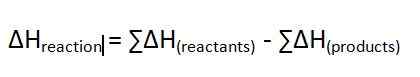
Quelle est la différence entre la chaleur de formation et la chaleur de réaction?
La chaleur de formation est le changement d'enthalpie pendant la formation d'une mole de substance à partir d'éléments purs dans des conditions standard. Le symbole de ce changement d'enthalpie est, ∆HF. La chaleur de réaction est le changement d'enthalpie d'une réaction qui se produit à une pression constante. Le symbole de ce changement d'enthalpie est, ∆H.

Résumé - chaleur de formation vs chaleur de réaction
L'enthalpie est le contenu énergétique. Le changement d'enthalpie indique combien d'échanges d'énergie entre les réactifs, les produits et l'environnement. La différence entre la chaleur de formation et la chaleur de réaction est que la chaleur de formation est le changement d'enthalpie pendant la formation d'une taupe d'une substance dans des conditions standard alors que la chaleur de réaction est le changement d'enthalpie lors d'une réaction chimique qui se produit à Une pression constante.
Référence:
1. LibreTexts. «Enthalpie standard de la formation.”Chemistry LibreTexts, LibreTexts, 9 février. 2017. Disponible ici
2. Britannica, les éditeurs de l'Encyclopaedia. «Chaleur de réaction.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4 avril. 2016. Disponible ici


