Différence entre la dépression de point de congélation et l'élévation du point d'ébullition
Différence clé - CONGUSING Dépression ponctuelle vs élévation du point d'ébullition
La dépression de point de congélation provoque une solution à geler à une température plus basse que le point de congélation du solvant pur en raison de l'ajout de solutés. L'élévation du point d'ébullition fait bouillir une solution à une température plus élevée que le point d'ébullition du solvant pur en raison de l'ajout de solutés. Par conséquent, la différence clé entre la dépression de point de congélation et l'élévation du point d'ébullition est que le La dépression du point de congélation diminue le point de congélation d'une solution tandis que l'élévation du point d'ébullition augmente le point d'ébullition d'une solution.
La dépression de point de congélation et l'élévation du point d'ébullition sont des propriétés colligatives de la matière. Cela signifie qu'ils dépendent uniquement de la quantité de solutés, et non de la nature du soluté.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la dépression de point de congélation
3. Qu'est-ce que l'élévation du point d'ébullition
4. Comparaison côte à côte - Dépression de point de congélation vs élévation du point d'ébullition dans la forme tabulaire
5. Résumé
Qu'est-ce que la dépression de point de congélation?
La dépression de point de congélation est la diminution du point de congélation d'un solvant en raison de l'ajout d'un soluté dans le solvant. C'est une propriété colligative. Cela signifie que la dépression de point de congélation ne dépend que de la quantité de solutés, et non de la nature du soluté. Lorsque la dépression de point de congélation s'est produite, le point de congélation du solvant diminue à une valeur inférieure à celle du solvant pur. La dépression de point de congélation est la raison pour laquelle l'eau de mer reste à l'état liquide même à 0 ° C (le point de congélation de l'eau pure). La dépression de point de congélation peut être donnée comme ci-dessous.
ΔtF = TF (solvant) - Tf (solution)
Ou
ΔtF = KFm
Dans ce,
- ΔtF La dépression de point de congélation est-elle,
- TF (solvant) est le point de congélation du solvant pur
- Tf (solution) est le point de congélation de la solution (solvant + solutés)
- KF est la constante de dépression de point de congélation
- m est la molialité de la solution.
Cependant, le soluté ajouté doit être un soluté non volatile, sinon le soluté n'affecte pas le point de congélation du solvant car il est volatilisé facilement. Non seulement pour les solutions, mais ce concept peut également être utilisé pour expliquer les changements de point de congélation des mélanges solides. Le composé solide finement en poudre a un point de congélation plus bas que le composé solide pur lorsque des impuretés sont présentes (mélange solide-solide).
Le point de congélation est la température à laquelle la pression de vapeur d'un solvant et la pression de vapeur La forme solide de ce solvant est égale. Si un soluté non volatile est ajouté à ce solvant, la pression de vapeur du solvant pur diminue. Ensuite, la forme solide du solvant peut rester en équilibre avec le solvant même à des températures plus basses que le point de congélation normal.
Qu'est-ce que l'élévation du point d'ébullition?
L'élévation du point d'ébullition est l'augmentation du point d'ébullition d'un solvant en raison de l'ajout d'un soluté dans le solvant. Ici, le point d'ébullition de la solution (après l'ajout de solutés) est plus élevé que celui du solvant pur. Par conséquent, la température à laquelle la solution commence à bouillir est supérieure à celle de la température habituelle.

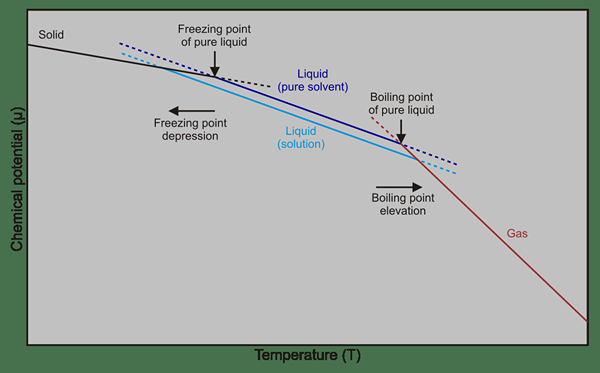
Figure 01: Point de congélation et différences de point d'ébullition entre le solvant pur et les solutions (solvant + solutés)
Cependant, le soluté ajouté devrait être un soluté non volatile, ou bien, le soluté volatilisera plutôt que de se dissoudre dans le solvant. L'élévation du point d'ébullition est également une propriété colligative afin qu'elle ne dépend que de la quantité de solutés (pas de la nature du soluté).
Δtb = TB (solvant) - TB (solution)
Ou
Δtb = Kbm
Dans ce,
- Δtb est l'élévation du point d'ébullition
- TB (solvant) est le point d'ébullition du solvant pur
- TB (solution) est le point d'ébullition de la solution (solvant + solutés)
- Kb est la constante d'élévation du point d'ébullition
- m est la molialité de la solution
Un exemple courant de ce phénomène est le point d'ébullition d'une solution aqueuse saline. Une solution saline bout à des températures plus élevées que 100 ° C (point d'ébullition de l'eau pure).
Quelle est la différence entre la dépression au point de congélation et l'élévation du point d'ébullition?
Point de congélation Vs Élévation du point d'ébullition | |
| La dépression de point de congélation est la diminution du point de congélation d'un solvant en raison de l'ajout d'un soluté dans le solvant. | L'élévation du point d'ébullition est l'augmentation du point d'ébullition d'un solvant en raison de l'ajout d'un soluté dans le solvant. |
| Température | |
| La dépression de point de congélation diminue le point de congélation d'une solution. | L'élévation du point d'ébullition augmente le point d'ébullition d'une solution. |
| Principe | |
| La dépression de point de congélation provoque une solution à geler à une température plus basse que le solvant pur. | L'élévation du point d'ébullition fait bouillir une solution à une température plus élevée que le solvant pur. |
| Équation | |
| La dépression de point de congélation est donnée par ΔtF = TF (solvant) - Tf (solution) ou ΔtF = KFm. | Élévation du point d'ébullition ΔTb = TB (solvant) - TB (solution) ou Δtb = Kbm. |
Résumé - Gellant Dépression ponctuelle vs élévation du point d'ébullition
La dépression de point de congélation et l'élévation du point d'ébullition sont deux grandes propriétés colligatives de la matière. La différence entre la dépression de point de congélation et l'élévation du point d'ébullition est que la dépression de point de congélation diminue le point de congélation d'une solution tandis que l'élévation du point d'ébullition augmente le point d'ébullition d'une solution.
Référence:
1.Helmenstine, Anne Marie. «Ce qu'est l'élévation du point d'ébullition et comment cela fonctionne."Thoughtco. Disponible ici
2.«Élévation du point d'ébullition.»Wikipedia, Wikimedia Foundation, 13 mars. 2018. Disponible ici
3."Abaissement du point de congélation.”Chemistry LibreTexts, LibreTexts, 19 février. 2018. Disponible ici
Image gracieuseté:
1.«Point de congélation Dépression et élévation du point d'ébullition» par travail érdérivatif Tomas (CC BY-SA 3.0) via Commons Wikimedia


