Différence entre les radicaux libres et l'ion
Le différence clé entre les radicaux libres et l'ion est que le Les radicaux libres ont un ou plusieurs électrons non appariés, mais les ions ont des électrons appariés.
Nous pouvons expliquer la différence entre les radicaux libres et l'ion des propriétés de base d'un ion et d'un radical libre. Un ion peut se produire sous forme de molécule ou d'atome avec une charge (positive ou négative) en raison de la perte ou du gain d'un électron. Les ions maintiennent une charge négative en raison d'un gain d'un électron et tiennent une charge positive en raison de la perte d'un électron. Les ions peuvent se produire sous forme d'espèces chimiques uniques ou multiples, selon le nombre d'électrons gagnés ou perdus. Les radicaux libres sont des molécules ou des atomes qui ont au moins un électron non apparié. Cet article concerne la différence entre les radicaux libres et l'ion, y compris leurs caractéristiques spéciales.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que les radicaux libres
3. Qu'est-ce que l'ion
4. Comparaison côte à côte - radical libre vs ion sous forme tabulaire
5. Résumé
Qu'est-ce que les radicaux libres?
Un radical libre est un atome ou un groupe d'atomes contenant un ou plusieurs électrons non appariés (s). Ils sont très réactifs en raison de la présence d'un électron non apparié. Les radicaux libres sont très instables et essaient d'obtenir une stabilité en acceptant l'électron nécessaire. Ils réagissent avec d'autres composés chimiques en capturant l'électron nécessaire. Les radicaux libres sont des intermédiaires importants dans les processus naturels. Nous pouvons désigner les radicaux libres par un point exposant vers la droite. Par exemple, h., CL., Ho., H3C.
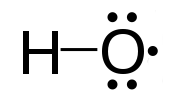
Figure 01: le radical hydroxyle
Les radicaux libres à longue durée de vie sont dans trois catégories: radicaux stables, radicaux persistants et diridicaux.
- Radicaux stables: Le principal exemple d'un radical stable est l'oxygène moléculaire o2. Les radicaux organiques contenant le système π conjugué peuvent vivre longtemps.
- Radicaux persistants: Ils sont à longue durée de vie en raison de la recroquevure stérique autour du centre radical et les rendent physiquement difficiles à réagir avec une autre molécule.
- Diridicaux: Certaines molécules ont deux centres radicaux, nous les nommons comme di-radicaux. Oxygène moléculaire naturellement (oxygène atmosphérique).
Qu'est-ce que l'ion?
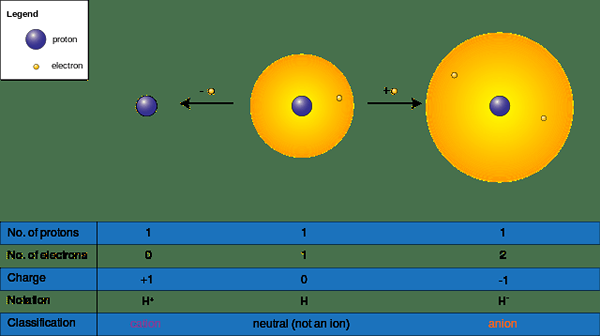
Les ions peuvent se former lorsqu'une espèce chimique gagne ou perd des électrons dans des réactions chimiques; Ils ont une charge positive (+) ou négative (). Ceux-ci obtiennent une charge négative en acceptant un (s) électronique (s) et une charge positive en donnant des électrons à une molécule de carence en électrons ou à un élément. L'acceptation ou le don d'électrons affecte directement la taille de l'ion; il change considérablement la taille moléculaire. Nous nommons un atome ou un groupe d'atomes sans charge négative ou positive comme «neutre»; Pour devenir un atome neutre ou une molécule, le nombre de protons doit être le même qu'un certain nombre d'électrons.
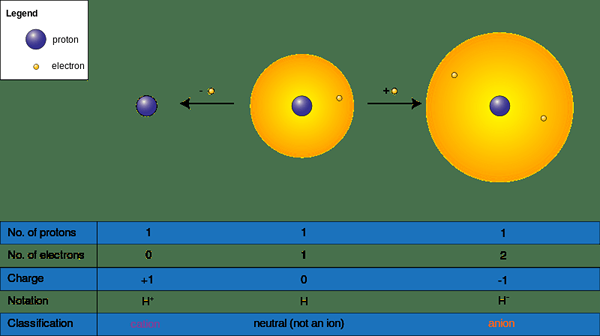
Figure 02: Formation de cations et d'anions
Par conséquent, il existe deux formes d'ions comme suit.
- Cations ou (+) ions - Souvent, les métaux relèvent de cette catégorie puisque les métaux perdent des électrons pour devenir positifs (+) chargés (na+, Ba2+, Californie2+, Al3+)
- Ions anions () - Souvent, les non-métaux relèvent de cette catégorie car les non-métaux gagnent des électrons pour devenir négatifs (- CL-, S2-, O2-, BR-)
Quelle est la différence entre les radicaux libres et l'ion?
La principale différence entre les radicaux libres et l'ion est que les radicaux libres ont un ou plusieurs électrons non appariés, mais les ions ont des électrons appariés. Par conséquent, les radicaux libres sont très instables tandis que les ions sont relativement stables. Par conséquent, c'est aussi une différence significative entre les radicaux libres et l'ion. Cependant, les radicaux peuvent exister par eux-mêmes tandis que la plupart des ions sont combinés avec des ions chargés de manière opposée. Lorsque l'on considère davantage sur leur stabilité, les radicaux libres deviennent stables en acceptant les électrons, mais les ions sont stables lorsqu'ils forment des complexes avec des composés chargés de manière opposée.
Une autre différence importante entre les radicaux libres et l'ion est que les ions détiennent toujours une charge, mais les radicaux libres ne sont pas des espèces chargées même si elles ont des électrons non appariés. Cette différence se produit parce que, dans un ion, le nombre total d'électrons n'est toujours pas égal au nombre de protons dans le noyau tandis que dans un radical libre, le nombre d'électrons est égal au nombre de protons.
L'infographie ci-dessous fournit plus de détails sur la différence entre les radicaux libres et l'ion.
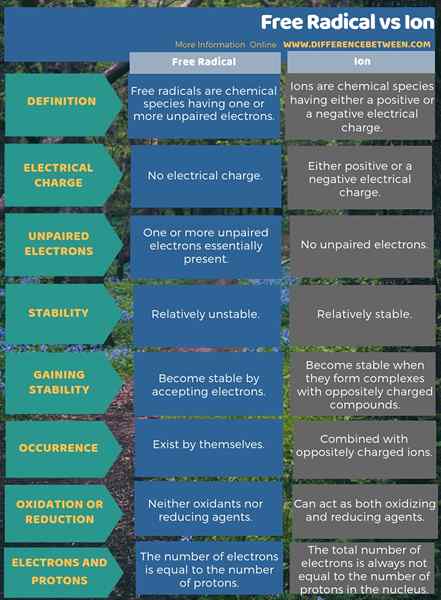
Résumé - Radical libre vs ion
Nous pouvons décrire à la fois les termes, les radicaux libres et les ions, en utilisant le nombre d'électrons appartenant à une espèce particulière. Ici, la différence la plus significative entre les radicaux libres et les ions est que les radicaux libres ont des électrons non appariés mais les ions ont des électrons appariés. Ainsi, les radicaux libres sont plus réactifs. D'un autre côté, les ions deviennent chimiquement stables en formant des composés avec des ions / molécules chargés de charges opposés.
Référence:
1. «Radical (chimie).»Wikipedia, Wikimedia Foundation, 8 octobre. 2018. Disponible ici
2. "Ion.»Wikipedia, Wikimedia Foundation, 16 octobre. 2018. Disponible ici
Image gracieuseté:
1.«Hydroxyl Radical» par Smokeyjoe - Propre travaux, (CC BY-SA 4.0) via Commons Wikimedia
2.«Ions» par Jkwchui - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


