Différence entre le premier ordre et la réaction pseudo de premier ordre
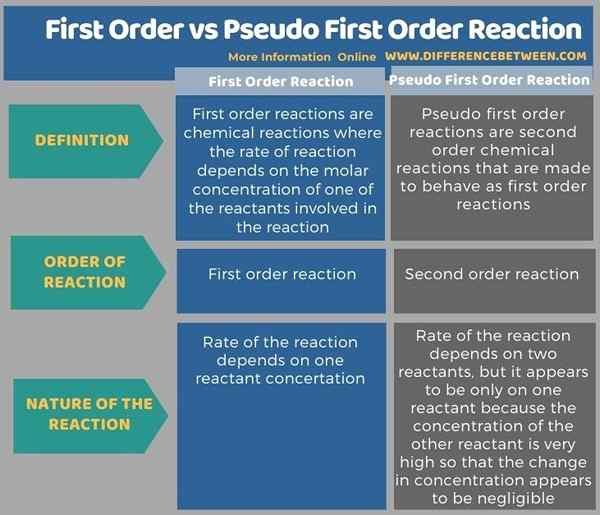
Le différence clé entre le premier ordre et la pseudo réaction du premier ordre est que Les réactions du premier ordre se déroulent à une vitesse qui dépend linéairement d'une seule concentration de réactif, tandis que les réactions pseudo de premier ordre sont des réactions de second ordre qui sont faites pour se comporter comme des réactions de premier ordre.
Le terme «pseudo» signifie «non authentique». Par conséquent, une pseudo réaction a les propriétés d'un type particulier de réactions chimiques, mais la réaction est en fait une réaction chimique complètement différente.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions de premier ordre
3. Quelles sont les réactions pseudo de premier ordre
4. Comparaison côte à côte - Réaction de premier ordre vs pseudo de premier ordre sous forme tabulaire
5. Résumé
Quelles sont les réactions de premier ordre?
Les réactions du premier ordre sont les réactions chimiques où la vitesse de réaction dépend de la concentration molaire de l'un des réactifs impliqués dans la réaction. Selon la définition de «l'ordre de réaction», la somme des pouvoirs auxquels les concentrations de réactifs sont augmentées dans l'équation de la loi sur la vitesse seront toujours 1 pour une réaction de premier ordre. Il peut y avoir un seul réactif qui participe à ces réactions ou à plus d'un réactif. Dans la première situation, la concentration de ce seul réactif détermine la vitesse de la réaction. À la deuxième situation, l'un des réactifs qui participent à la réaction déterminera la vitesse de la réaction.
Afin de comprendre ce concept, considérons la réaction de décomposition de n2O5, qui forme non2 et o2 gaz comme produits. Puisqu'il n'a qu'un seul réactif, nous pouvons écrire la réaction et l'équation de vitesse comme suit.
2n2O5 (g) → 4NO2 (g) + O2 (g)
Taux = k [n2O5 (g)]]m
Dans cette équation de vitesse, k est la constante de vitesse pour cette réaction et m est l'ordre de la réaction. Ensuite, les déterminations expérimentales devraient donner la valeur de m comme 1. Par conséquent, nous pouvons identifier qu'il s'agit d'une réaction de premier ordre.
Quelles sont les réactions pseudo de premier ordre?
Pseudo Les réactions de premier ordre sont des réactions chimiques de second ordre qui sont faites pour se comporter comme des réactions de premier ordre. Par conséquent, ces réactions peuvent également être appelées réactions bimoléculaires. Ce type de réactions se produit lorsqu'un matériau réagissant se produit une grande concentration en excès dans le mélange réactionnel, et donc, il apparaît comme une concentration constante par rapport aux concentrations d'autres substances.
Un échantillon de réaction du second ordre peut être donné comme suit:
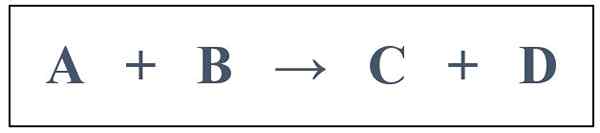
Dans cette réaction, la vitesse de la réaction dépend à la fois de la concentration «A» et de la concentration «B». Mais la concentration de «A» est très élevée par rapport à la concentration de «B», et le changement de concentration de «A» pendant la progression de la réaction semble être négligeable. Ensuite, nous pouvons prédire l'ordre de cette réaction comme 1 parce que le changement de concertation apparaît uniquement pour «B». Cependant, la réaction est en fait une réaction du second ordre car la vitesse de la réaction dépend des deux réactifs. Par conséquent, nous pouvons catégoriser ce type de réactions comme des réactions pseudo de premier ordre.
Quelle est la différence entre le premier ordre et la réaction pseudo de premier ordre?
Les réactions du premier ordre et les pseudo réactions de premier ordre sont différentes les unes des autres. La principale différence entre le premier ordre et la réaction de pseudo du premier ordre est que les réactions de premier ordre se déroulent à une vitesse qui dépend linéairement uniquement d'une concentration de réactive tandis que les réactions pseudo de premier ordre sont les réactions de second ordre qui sont faites pour se comporter comme des réactions de premier ordre du premier ordre.
Vous trouverez ci-dessous une tabulation sommaire de la différence entre le premier ordre et la réaction de premier ordre pseudo.

Résumé - Réaction de premier ordre vs pseudo de premier ordre
Les réactions du premier ordre et les pseudo réactions de premier ordre sont différentes les unes des autres. La principale différence entre le premier ordre et la réaction de pseudo du premier ordre est que les réactions de premier ordre se déroulent à une vitesse qui dépend linéairement uniquement d'une concentration de réactive tandis que les réactions pseudo de premier ordre sont les réactions de second ordre qui sont faites pour se comporter comme des réactions de premier ordre du premier ordre.
Référence:
1. «Pseudo Réaction de premier ordre - Loi rate, ordre de réaction et exemples." ByJus, 12 août. 2020, disponible ici.


