Différence entre le sulfate ferreux et le glycinate de fer
Le différence clé entre le sulfate ferreux et le glycinate de fer est que Le sulfate ferreux est moins absorbé et plus toxique que le glycinate de fer lorsqu'il est utilisé dans les médicaments.
Le sulfate ferreux et le glycinate de fer sont utiles comme suppléments de fer. Cependant, ils ont des propriétés différentes, et leur contenu en fer est également différent. Normalement, nous obtenons du fer de la nourriture que nous mangeons. Mais, si le corps n'obtient pas assez de fer, alors nous obtenons une anémie en fer à la carence en fer. Le sulfate ferreux et le glycinate de fer sont des médicaments pour traiter cette maladie.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le sulfate ferreux
3. Qu'est-ce que le glycinate de fer
4. Comparaison côte à côte - sulfate ferreux vs glycinate de fer sous forme tabulaire
5. Résumé
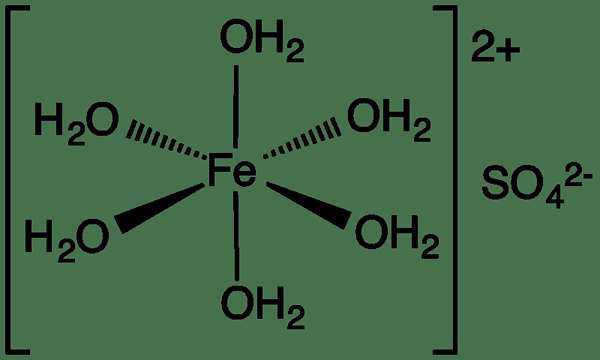
Qu'est-ce que le sulfate ferreux?
Le sulfate ferreux est un type de supplément de fer qui désigne une gamme de sels avec la formule chimique feso4.xh2O. Il est utile pour éviter de faibles niveaux de fer dans le sang. Le plus souvent, cela se produit sous la forme de l'heptahydrate. De plus, il a une apparence bleu-vert. En dehors de ses applications médicinales, il a également des utilisations industrielles.

Figure 01: Structure du sulfate ferreux
Lorsque vous envisagez la production de ce composé, il se forme comme un sous-produit pendant la finition de l'acier avant le placage ou le revêtement. Ici, la feuille d'acier passe à travers des bains de décapage de sulfurique où se produit la formation de sulfate ferreux. De plus, ce composé peut se former en grande quantité lors de la production de dioxyde de titane à partir de l'ilménite en utilisant le processus de sulfate.
En tant que médicament, les médecins recommandent souvent du sulfate ferreux pour une carence en fer bien que ce ne soit pas la meilleure option. Il est moins absorbé et aussi toxique. De plus, il peut provoquer plusieurs effets secondaires tels que les nausées, les vomissements, les douleurs à l'estomac, la constipation, etc.
Qu'est-ce que le glycinate de fer?
Le glycinate de fer est un type de supplément de fer qui est meilleur que les autres suppléments de fer. Notre corps absorbe facilement ce composé, et il est également relativement moins toxique. Cela signifie; il a moins d'effets secondaires et est plus biodisponible. Cependant, cela provoque quelques symptômes gastro-intestinaux. Les avantages de l'utilisation du glycinate de fer comprennent la fourniture de micronutriments essentiels requis par tous les animaux, une efficacité élevée, une bonne solubilité et une absorption élevée, une manipulation facile, une biodisponibilité élevée, etc.
Quelle est la différence entre le sulfate ferreux et le glycinate de fer?
Le sulfate ferreux est un type de supplément de fer qui désigne une gamme de sels avec la formule chimique feso4.xh2O. Le glycinate de fer est un type de supplément de fer qui est meilleur que les autres suppléments de fer. La principale différence entre le sulfate ferreux et le glycinate de fer est que le sulfate ferreux est moins absorbé et plus toxique que le glycinate de fer lorsqu'il est utilisé dans les médicaments.
De plus, il y a une différence entre le sulfate ferreux et le glycinate de fer en termes de leurs effets secondaires. C'est-à-dire; Le sulfate ferreux a des effets secondaires tels que les nausées, les vomissements, les douleurs à l'estomac, la constipation, etc., Alors que pour le glycinate de fer, il n'y a que quelques effets secondaires, y compris les symptômes gastro-intestinaux. Par conséquent, l'efficacité du sulfate ferreux est inférieure à celle du glycinate de fer.
En dessous de l'infographie résume la différence entre le sulfate ferreux et le glycinate de fer.

Résumé - Sulfate ferreux vs glycinate de fer
La principale différence entre le sulfate ferreux et le glycinate de fer est que le sulfate ferreux est moins absorbé et plus toxique que le glycinate de fer lorsqu'il est utilisé dans les médicaments. Par conséquent, le sulfate ferreux est moins efficace que le glycinate de fer.
Référence:
1. «Oral de sulfate ferreux: utilisations, effets secondaires, interactions, images, avertissements et dosage.»WebMD, WebMD, disponible ici.
2. «Traitement de carence en fer pour les symptômes de fatigue chronique.»University Health News, 5 mars. 2019, disponible ici.
Image gracieuseté:
1. «Fe (H2O) 6SO4» par Smokefoot - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


