Différence entre l'évaporation et la vaporisation

Le différence clé entre l'évaporation et la vaporisation est que L'évaporation d'un liquide se produit à une température qui est en dessous du point d'ébullition de ce liquide, tandis que la vaporisation se produit au point d'ébullition du liquide.
L'évaporation et la vaporisation se réfèrent aux processus dans lesquels un liquide se transforme en sa phase gazeuse. Bien que l'évaporation ne se produise que dans les liquides, la vaporisation peut également se produire dans les solides; Nous appelons cette sublimation (conversion de la phase solide directement en phase gazeuse sans passer par une phase liquide).
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'évaporation
3. Qu'est-ce que la vaporisation
4. Comparaison côte à côte - Évaporation vs vaporisation sous forme tabulaire
5. Résumé
Qu'est-ce que l'évaporation?
L'évaporation est la conversion d'un liquide en sa phase gazeuse à une température qui est en dessous du point d'ébullition du liquide. Les molécules d'un liquide ont des énergies cinétiques différentes. Lorsque nous fournissons de l'énergie de l'extérieur vers le liquide (comme la chaleur), l'énergie cinétique de ces molécules liquides augmente. Lorsque l'énergie est suffisante pour que les molécules à la surface surmontent les forces intermoléculaires entre elles, les molécules ont tendance à échapper à la surface et à se convertir en état de gaz.

Figure 01: L'évaporation se produit à la surface de l'eau
Cependant, certaines des molécules qui entrent dans la phase gazeuse par évaporation peuvent rejoindre le liquide par condensation. Cela représente un équilibre entre le taux d'évaporation et le taux de condensation. De plus, une pression constante de vapeur est établie à ce stade. Si nous augmentons la température du liquide à ces points, cela entraîne une augmentation du taux d'évaporation puisque l'énergie cinétique des molécules augmente. Par conséquent, la quantité de molécules occupant l'espace au-dessus du liquide augmente.
Qu'est-ce que la vaporisation?
La vaporisation est la conversion d'une phase liquide en une phase gazeuse au point d'ébullition du liquide. Par conséquent, la vaporisation se produit à la température d'ébullition du liquide.

Figure 02: Eau bouillante
Afin de faire bouillir un liquide, la pression de vapeur du liquide doit être égale à la pression externe entourant le liquide. Cela signifie que les molécules à la surface du liquide devraient avoir une énergie cinétique qui est suffisante pour surmonter les forces intermoléculaires entre les molécules liquides; Par conséquent, ces molécules peuvent quitter le liquide en convertissant en phase gazeuse.
Quelle est la différence entre l'évaporation et la vaporisation?
L'évaporation et la vaporisation sont des processus où une substance liquide est convertie en sa phase gazeuse. La principale différence entre l'évaporation et la vaporisation est que l'évaporation d'un liquide se produit à une température qui est en dessous du point d'ébullition de ce liquide, tandis que la vaporisation se produit au point d'ébullition du liquide. De plus, l'évaporation se produit lorsque la pression de vapeur du liquide est inférieure à la pression externe entourant le liquide pendant que la vaporisation se produit lorsque la pression de vapeur du liquide est égale à la pression externe.
De plus, pendant l'évaporation, les molécules à la surface du liquide partent en premier tandis que la vaporisation peut se produire à n'importe quel endroit du liquide (c'est pourquoi nous pouvons voir bouillonner de l'eau au fond du récipient lors du chauffage).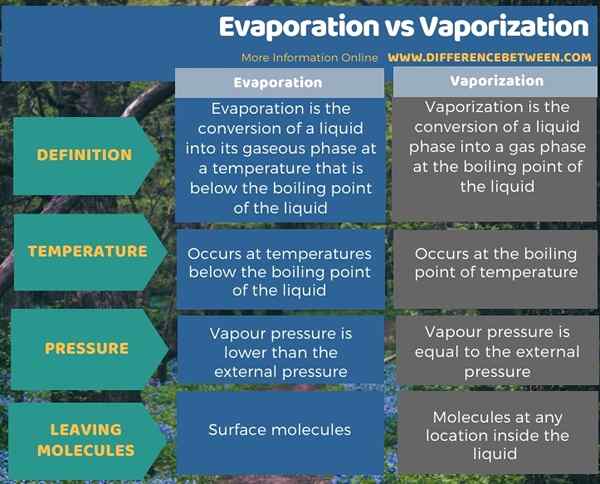
Résumé - Évaporation vs vaporisation
L'évaporation et la vaporisation se réfèrent aux processus dans lesquels une substance liquide se transforme en sa phase gazeuse. La principale différence entre l'évaporation et la vaporisation est que l'évaporation d'un liquide se produit à une température qui est en dessous du point d'ébullition de ce liquide, tandis que la vaporisation se produit au point d'ébullition du liquide.
Référence:
1. Helmenstine, Todd. «Problème d'exemple de chaleur de vaporisation."Thoughtco, Jan. 29, 2020, disponible ici.
2. Helmenstine, Anne Marie. «Définition de l'évaporation en chimie."Thoughtco, Jan. 29, 2020, disponible ici.
Image gracieuseté:
1. «Vaporisation» par Tristan Schmurr (CC par 2.0) via Flickr
2. «Eau bouillante dans la casserole» par Appliance City (CC par 2.0) via Flickr


