Différence entre l'éthylène et l'éthylidène
Le différence clé entre l'éthylène et l'éthylidène est que L'éthylène est un composé chimique neutre, tandis que l'éthylidène est un composé radical divalent.
Les formes radicales d'éthylidène à partir de molécules d'éthylène via le réarrangement des molécules; La molécule d'éthylène contient deux atomes de carbone liés les uns aux autres via une double liaison, et il y a deux atomes d'hydrogène attachés à chaque atome de carbone. Le radical d'éthylidène, en revanche, contient deux atomes de carbone liés les uns aux autres via une seule liaison et il y a trois atomes d'hydrogène attachés à un atome de carbone et un atome d'hydrogène attaché à l'autre atome de carbone. Par conséquent, le deuxième atome de carbone contient deux électrons non appariés.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthylène
3. Qu'est-ce que l'éthylidène
4. Relation entre l'éthylène et l'éthylidène
5. Comparaison côte à côte - éthylène vs éthylidène sous forme tabulaire
6. Résumé
Qu'est-ce que l'éthylène?
L'éthylène est un composé organique ayant la formule chimique C2H4. Il y a deux atomes de carbone liés l'un à l'autre via une double liaison (une liaison PI et une liaison Sigma). Par conséquent, la molécule d'éthylène a deux atomes de carbone hybridés SP2. Puisqu'un atome de carbone est capable de former quatre liaisons chimiques, il y a deux atomes d'hydrogène liés à chaque atome de carbone via des liaisons uniques. Par conséquent, la molécule d'éthylène a une structure planaire.

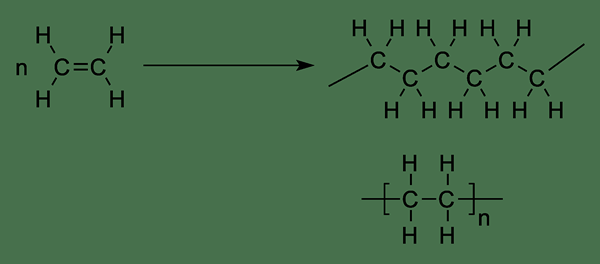
Figure 01: Polymérisation de l'éthylène
Certains faits chimiques sur l'éthylène sont les suivants:
- Formule chimique = C2H4
- Masse molaire = 28.05 g / mol
- État physique à température ambiante = c'est un gaz inflammable incolore et inflammable
- Odeur = odeur douce
- Point de fusion = −169.2 ° C
- Point d'ébullition = −103.7 ° C
- Solubilité dans l'eau = légèrement soluble
- Nom IUPAC = Ethène
La principale source d'éthylène est le pétrole brut et les gaz naturels. Il y a trois processus principaux utilisés pour produire de l'éthylène à partir de ces sources. Ils sont,
- Fissure à la vapeur de l'éthane et du propane
- Craquage à la vapeur de naphtha
- Craquage catalytique d'huile de gaz
L'éthylène est important comme monomère pour la production de polymères tels que le polyéthylène via une polymérisation d'addition. Le polyéthylène est un matériau d'emballage commun. De plus, dans les systèmes biologiques, l'éthylène est important comme hormone végétale car elle stimule le processus de maturation des fruits.
Qu'est-ce que l'éthylidène?
L'éthylidène est un radical ayant la formule chimique CH3-CH: c'est un radical divalent car il a deux électrons non appariés. Le radical d'éthylidène peut être préparé via l'élimination de deux atomes d'hydrogène du même atome de carbone d'éthane. De plus, le radical éthylidène peut également se former lorsqu'un réarrangement des atomes se produit dans la molécule d'éthylène.
Quelle est la relation entre l'éthylène et l'éthylidène?
- L'éthylène et l'éthylidène sont des composés chimiques organiques.
- Des radicaux éthylidènes sont formés à partir de molécules d'éthylène.
Quelle est la différence entre l'éthylène et l'éthylidène?
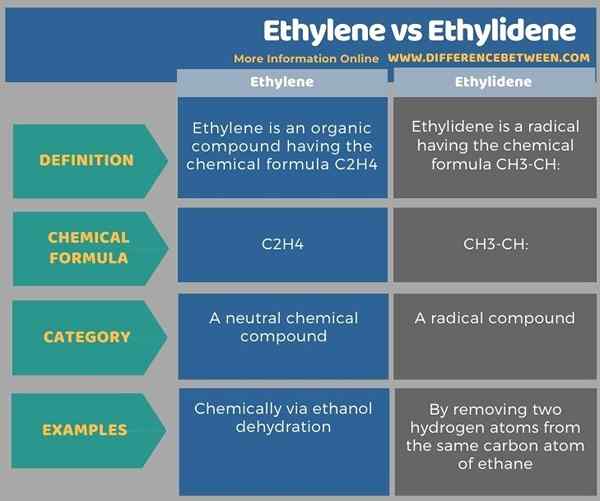
L'éthylène est un composé organique ayant la formule chimique C2H4 tandis que l'éthylidène est un radical ayant la formule chimique CH3-CH: la différence clé entre l'éthylène et l'éthylidène est que l'éthylène est un composé chimique neutre, tandis que l'éthyllidène est un composé radical divisé. De plus, l'éthylidène peut être préparé à partir de l'élimination de deux atomes d'hydrogène du même atome de carbone d'éthane. L'éthylène, en revanche, peut être préparé chimiquement via le processus de déshydrogénation de l'éthanol.
L'infographie suivante compare à la fois les composés et tabule les différences entre l'éthylène et l'éthylidène côte à côte.
Résumé - Ethylène vs éthylidène
En un mot, l'éthylène et l'éthylidène sont des composés chimiques organiques. L'éthylidène peut être préparé à partir de l'élimination de deux atomes d'hydrogène du même atome de carbone d'éthane. La principale différence entre l'éthylène et l'éthylidène est que l'éthylène est un composé chimique neutre, tandis que l'éthylidène est un composé radical divalent.
Référence:
1. «Ethylène - un aperçu." Sujets ScienceDirect, Disponible ici.
2. "Éthylène." Encyclopædia Britannica, Encyclopædia Britannica, Inc., Disponible ici.
Image gracieuseté:
1. «Radical Polymérisation Ethylène» par V8rik à l'anglais Wikipedia (CC BY-SA 3.0) via Commons Wikimedia


