Différence entre l'éthanol et le propanol
Le différence clé entre l'éthanol et le propanol est que le L'éthanol contient deux atomes de carbone par molécule tandis que le propanol contient 3 atomes de carbone par molécule.
L'éthanol et le propanol sont des composés alcoolisés qui contiennent un groupe hydroxyle (-OH) comme groupe fonctionnel de la molécule. De plus, les deux sont les plus simples parmi les alcools. Étant donné que l'éthanol n'a que deux atomes de carbone, il n'y a qu'une seule molécule que nous pouvons nommer en tant qu'éthanol. Cependant, le propanol a trois atomes de carbone. Par conséquent, il peut y avoir plusieurs structures pour la même molécule en raison de différentes arrangements structurels et spatiaux de ces atomes. Nous appelons ces différentes structures comme des «isomères» du propanol. Cependant, nous nous référons généralement à 1-propanol lorsque nous parlons de ce composé.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthanol
3. Qu'est-ce que le propanol
4. Comparaison côte à côte - éthanol vs propanol sous forme tabulaire
5. Résumé
Qu'est-ce que l'éthanol?
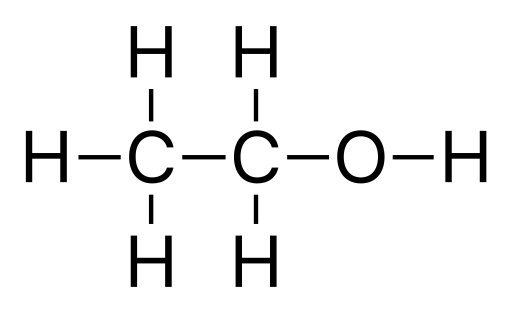
L'éthanol est un composé organique ayant la formule chimique C2H5OH. Nous pouvons écrire cette formule comme ch3−CH2−OH ou comme c2H5−Oh. Quoi qu'il en soit, il représente le groupe hydroxyle (-OH) dans l'alcool. Ce composé est volatile et très inflammable. De plus, c'est un liquide incolore avec une odeur caractéristique. Surtout, c'est le principal composé alcoolique que nous pouvons trouver dans les boissons alcoolisées.

Figure 01: Structure chimique de l'éthanol
Nous pouvons produire ce composé via la fermentation des sucres par la levure comme voie biologique. Ou bien, nous pouvons utiliser des processus pétrochimiques. En regardant ses propriétés chimiques, la masse molaire de ce composé est 46.07 g / mol. Le point de fusion est autour de -114.14 ° C, et le point d'ébullition est d'environ 78.24 ° C. Il est également miscible avec l'eau car il peut former des liaisons hydrogène avec des molécules d'eau.
Lorsque vous envisagez les utilisations de l'éthanol, il y a des utilisations médicales, des utilisations récréatives, du carburant et comme solvant. Il a des propriétés antiseptiques et nous pouvons également l'utiliser comme antidote. Par conséquent, il est utile comme solvant médicinal dans l'industrie pharmaceutique. De plus, c'est un carburant moteur commun, et de même, il est utile comme additif de carburant.
Qu'est-ce que le propanol?
Le propanol est un composé organique ayant la formule chimique C3H8O. C'est un liquide incolore et a une odeur légère et alcoolisée. Puisqu'il y a trois atomes de carbone dans la molécule de propanol, il a des isomères. Cela signifie que ces trois atomes de carbone peuvent organiser de différentes manières pour donner des arrangements et des structures différents de la même molécule. E.g., 1-propanol et 2-propanol.
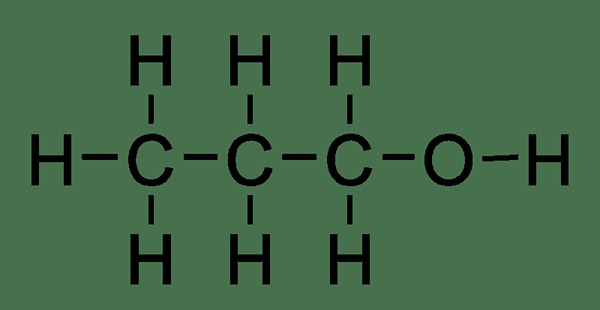
Figure 02: Structure chimique du propanol
De plus, la masse molaire de ce composé est de 60.1 g / mol. Pour 1-propanol, le point de fusion est de -126 ° C et le point d'ébullition est de 98 ° C. Aussi, identique à l'éthanol, le propanol est miscible avec l'eau car il peut former des liaisons hydrogène avec le groupe fonctionnel hydroxyle. Ainsi, nous pouvons produire ce composé via une hydrogénation catalytique de la propionaldéhyde.
Quelle est la différence entre l'éthanol et le propanol?
L'éthanol est un composé organique ayant la formule chimique C2H5Oh tandis que le propanol est un composé organique ayant la formule chimique C3H8O. Ce sont des composés alcoolisés. Mais, une molécule d'éthanol contient deux atomes de carbone tandis qu'une molécule de propanol contient trois atomes de carbone. Par conséquent, c'est la principale différence entre l'éthanol et le propanol. De plus, une autre différence entre l'éthanol et le propanol est que l'éthanol n'a pas d'isomères, mais le propanol a des isomères. Dans l'ensemble, l'éthanol et le propanol sont deux composés chimiques différents ayant des compositions différentes d'atomes, donc des masses molaires différentes, des points de fusion et des points d'ébullition.
L'infographie ci-dessous présente la différence entre l'éthanol et le propanol sous forme tabulaire.

Résumé - Ethanol vs propanol
L'éthanol et le propanol sont des composés alcoolisés. Mais, la principale différence entre l'éthanol et le propanol est que l'éthanol contient deux atomes de carbone par molécule tandis que le propanol contient 3 atomes de carbone par molécule.
Référence:
1. «Ethanol.»Wikipedia, Wikimedia Foundation, 11 octobre. 2018. Disponible ici
2. «1-propanol.»Wikipedia, Wikimedia Foundation, 4 juillet 2018. Disponible ici
Image gracieuseté:
1.«Éthanol-structure» par Lukáš Mižoch - Propre travaux, (domaine public) via Commons Wikimedia
2.«Propanol Structure plate» par Cacycle - Propre travaux, (domaine public) via Commons Wikimedia


