Différence entre l'égalisation et la neutralisation
Le différence clé entre l'égalisation et la neutralisation est que L'égalisation se réfère à l'équilibrage des atomes d'une équation de réaction chimique, tandis que la neutralisation est l'équilibrage de l'acidité ou de la basicité pour obtenir une solution neutre.
Bien que les termes l'égalisation et la neutralisation semblent similaires, ils sont différents les uns des autres dans le sens et l'application. Cependant, ces deux termes se réfèrent au processus d'équilibrage des composants chimiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'égalisation
3. Qu'est-ce que la neutralisation
4. Comparaison côte à côte - Égalisation vs neutralisation sous forme tabulaire
5. Résumé
Qu'est-ce que l'égalisation?
L'égalisation est la technique d'équilibrage des atomes d'une équation de réaction chimique. Ici, nous devons égaliser le nombre d'atomes du côté réactif au nombre d'atomes du côté produit. Cela signifie que l'atomicité avant et après la réaction chimique doit être égale. À cette fin, nous pouvons utiliser des coefficients stoechiométriques devant les réactifs et les produits (un coefficient stoechiométrique est un nombre qui apparaît avant le symbole des espèces chimiques dans l'équation pour une réaction chimique. Ces valeurs sont des valeurs sans unité).
Les étapes suivantes nous aident à équilibrer une équation chimique pour une réaction chimique simple.
- Écrivez l'équation déséquilibrée. (E.g. C3H8 + O2 ⟶ CO2 + H2O)
- Déterminez les nombres de chaque atome présent à la fois dans le côté réactif et le côté produit. (Du côté réactif, il y a 8 atomes d'hydrogène, 3 atomes de carbone et 2 atomes d'oxygène. Dans le côté du produit, il y a 2 atomes d'hydrogène, 3 atomes d'oxygène et un atome de carbone).
- Économisez des atomes d'hydrogène et d'oxygène pour la fin.
- Utilisez des coefficients stœchiométriques pour équilibrer les éléments uniques. (Utilisez le coefficient stoichiométrique «3» devant le CO2) e.g. C3H8 + O2 ⟶ 3CO2 + H2O
- Équilibrer le nombre d'atomes d'hydrogène. (Il y a 8 atomes d'hydrogène du côté réactif mais seulement 2 du côté produit, nous devons donc utiliser le coefficient stoechiométrique 4 devant H2O) e.g. C3H8 + O2 ⟶ 3CO2 + 4H2O
- Équilibrer le nombre d'atomes d'oxygène. E.g. C3H8 + 5O2 ⟶ 3CO2 + 4h2O
Qu'est-ce que la neutralisation?
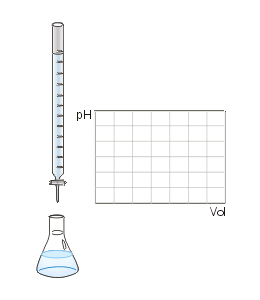
Une réaction de neutralisation est une réaction chimique entre un acide et une base, qui produit une solution neutre. Une solution neutre aura toujours pH 7. Cette réaction implique la combinaison d'ions H + et d'ions pour former des molécules d'eau.
Si le pH final d'un mélange réactionnel acide et de base est de 7, cela signifie que des quantités égales d'ions H + et OH- ont réagi ici (afin de former une molécule d'eau, un ion H + et un oh- ions sont nécessaires). Les acides et les bases réagis peuvent être solides ou faibles. Les réactions varient en fonction de ce fait.

Figure 01: une puissante titration de neutralisation de la base acide
Il existe quatre types différents de réactions de neutralisation: de fortes réactions de base à fort acide, de fortes réactions de base de la feme-acide, de faibles réactions de base acide-wak-wak et de faibles réactions de base de l'élevage acide. Ces réactions subissent une neutralisation à différents degrés, en fonction de la force de l'acide et de la base.
Quelle est la différence entre l'égalisation et la neutralisation?
La principale différence entre l'égalisation et la neutralisation est que l'égalisation se réfère à l'équilibrage des atomes d'une équation de réaction chimique tandis que la neutralisation est l'équilibrage de l'acidité ou de la basicité pour obtenir une solution neutre. De plus, l'égalisation consiste à utiliser le nombre d'atomes dans les réactifs et les produits et l'utilisation des états d'oxydation des atomes, tandis que la neutralisation consiste à déterminer la force des acides et des bases impliquées dans la réaction.
En dessous de l'infographie résume la différence entre l'égalisation et la neutralisation.
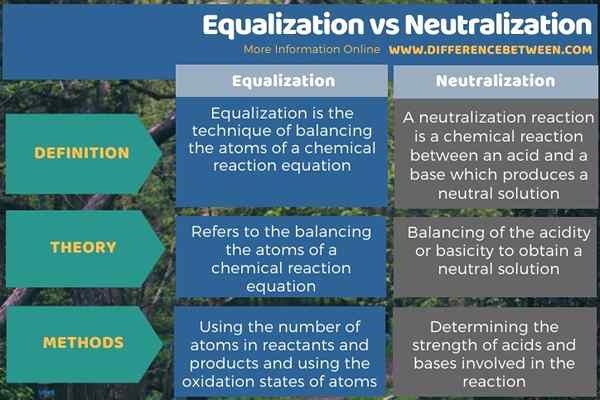
Résumé - Égalisation vs neutralisation
Bien que le terme égalisation et neutralisation semblent similaires, ils sont différents les uns des autres dans la définition et l'application. La principale différence entre l'égalisation et la neutralisation est que l'égalisation se réfère à l'équilibre des atomes d'une équation de réaction chimique, tandis que la neutralisation équilibre l'acidité ou la basicité pour obtenir une solution neutre.
Image gracieuseté:
2. «Titolazion» de Luigi Chiesa - Draw par Luigi Chiesa (domaine public) via Commons Wikimedia


