Différence entre l'enthalpie et la chaleur
Le différence clé entre l'enthalpie et la chaleur est que L'enthalpie est la quantité de chaleur transférée lors d'une réaction chimique à pression constante tandis que la chaleur est une forme d'énergie.
À des fins d'étude en chimie, nous divisons l'univers en deux: un système et environnant. Le système fait l'objet de notre enquête tandis que le reste est l'environnement. La chaleur et l'enthalpie sont deux termes décrivant le flux d'énergie et les propriétés d'un système.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'enthalpie
3. Qu'est-ce que la chaleur
4. Comparaison côte à côte - enthalpie vs chaleur sous forme tabulaire
5. Résumé
Qu'est-ce que l'enthalpie?
Dans la thermodynamique, l'énergie totale d'un système est l'énergie interne. L'énergie interne spécifie l'énergie cinétique et potentielle totale des molécules dans le système. L'énergie interne d'un système peut être modifiée soit en travaillant sur le système, soit en le chauffant. Cependant, le changement d'énergie interne n'est pas égal à l'énergie qui se transfère comme chaleur lorsque le système est capable de modifier son volume.
L'enthalpie est une propriété thermodynamique et nous pouvons le désigner par H. La relation mathématique pour ce terme est la suivante:
H = u + pv
Ici, H est l'enthalpie et U est l'énergie interne, P est la pression et V est le volume du système. Cette équation montre que l'énergie fournie comme chaleur à une pression constante est égale au changement d'enthalpie. Le terme PV explique l'énergie requise par le système pour modifier le volume par rapport à la pression constante. Par conséquent, l'enthalpie est essentiellement la chaleur d'une réaction à pression constante.

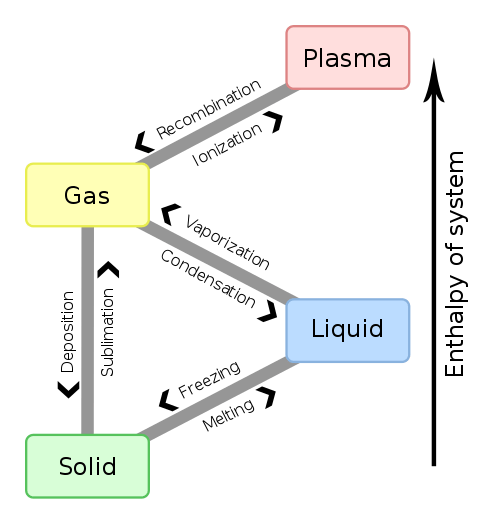
Figure 01: Changements d'enthalpie pour les changements de phase de matière
De plus, le changement d'enthalpie (∆H) pour une réaction dans une température et une pression donnés est obtenu en soustrayant l'enthalpie des réactifs de l'enthalpie des produits. Si cette valeur est négative, alors la réaction est exothermique. Si la valeur est positive, la réaction est considérée comme endothermique. Le changement d'enthalpie entre toute paire de réactifs et de produits est indépendant du chemin entre eux. De plus, le changement d'enthalpie dépend de la phase des réactifs. Par exemple, lorsque l'oxygène et les gaz hydrogène réagissent pour produire de la vapeur d'eau, le changement d'enthalpie est de -483.7 kJ. Mais, lorsque les mêmes réactifs réagissent pour produire de l'eau liquide, le changement d'enthalpie est de -571.5 kJ.
Qu'est-ce que la chaleur?
La capacité d'un système à travailler est l'énergie de ce système. Nous pouvons travailler sur le système ou le système peut travailler, ce qui conduit à augmenter ou à diminuer l'énergie du système en conséquence. L'énergie d'un système peut être modifiée, non seulement par l'œuvre elle-même, par d'autres moyens aussi. Lorsque l'énergie d'un système change en raison de la différence de température entre le système et son environnement, nous appelons cette énergie transférée comme chaleur (Q); c'est-à-dire que l'énergie a été transférée sous forme de chaleur.

Le transfert de chaleur a lieu de la température élevée à la basse température, qui est selon un gradient de température. De plus, ce processus se poursuit jusqu'à ce que la température entre le système et les environs atteignent le même niveau. Il existe deux types de processus de transfert de chaleur. Ce sont des processus endothermiques et des processus exothermiques. Le processus endothermique est un processus dans lequel l'énergie pénètre dans le système depuis l'environnement comme chaleur tandis qu'un processus exothermique est celui où la chaleur est transférée du système vers l'environnement sous forme de chaleur.
Quelle est la différence entre l'enthalpie et la chaleur?
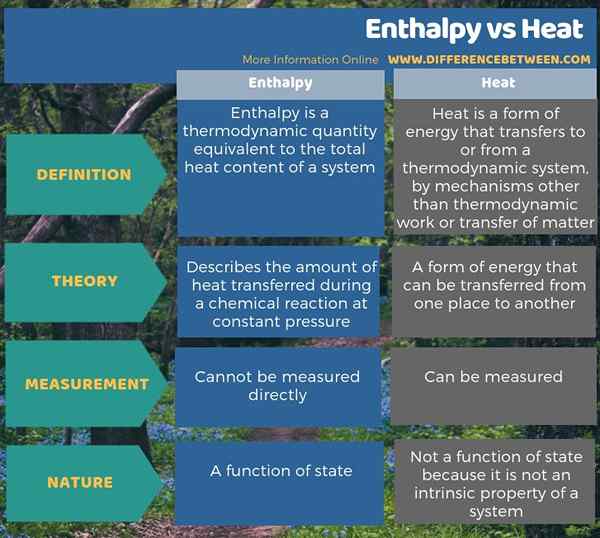
La plupart du temps, nous utilisons les termes enthalpie et chaleur de manière interchangeable, mais il y a une légère différence entre enthousiasme et chaleur. La principale différence entre l'enthalpie et la chaleur est que l'enthalpie décrit la quantité de chaleur transférée lors d'une réaction chimique à pression constante tandis que la chaleur est une forme d'énergie. De plus, l'enthalpie est fonction de l'état, tandis que la chaleur n'est pas puisque la chaleur n'est pas une propriété intrinsèque d'un système. De plus, nous ne pouvons pas mesurer directement l'enthalpie, nous devons donc le calculer par des équations; Cependant, nous pouvons mesurer la chaleur directement comme un changement de température.
Résumé - Enthalpie vs chaleur
Nous utilisons souvent les termes enthalpie et chaleur de manière interchangeable, mais il y a une légère différence d'enthalpie et que la chaleur est que l'enthalpie décrit la quantité de chaleur transférée lors d'une réaction chimique à une pression constante tandis que la chaleur est une forme d'énergie.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'enthalpie en chimie et physique."Thoughtco, août. 22, 2019, disponible ici
Image gracieuseté:
1. «Changement de phase - en.»Par F L A N K E R, Penubag - Propre travaux (domaine public) via Commons Wikimedia
2. «Fire Flare-Up Heat Free Picture» (CC0) via NeedPix.com


