Différence entre les réactions endothermiques et exothermiques
Le différence clé entre les réactions endothermiques et exothermiques est que Les réactions endothermiques absorbent l'énergie de l'environnement environnant, tandis que les réactions exothermiques libèrent l'énergie à l'environnement.
L'énergie est la capacité de travailler. Dans un système, l'énergie peut fonctionner; il peut se transformer en d'autres formes telles que la chaleur, le son, la lumière, etc. Lorsque l'énergie d'un système change à la suite d'une différence de température entre le système et l'environnement, nous disons que l'énergie a été transférée comme chaleur. Une réaction endothermique est un processus dans lequel l'énergie est acquise de son environnement vers le système, tandis qu'une réaction exothermique est un processus qui libère l'énergie du système à l'environnement.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions endothermiques
3. Quelles sont les réactions exothermiques
4. Comparaison côte à côte - réactions endothermiques vs exothermiques sous forme tabulaire
5. Résumé
Quelles sont les réactions endothermiques?
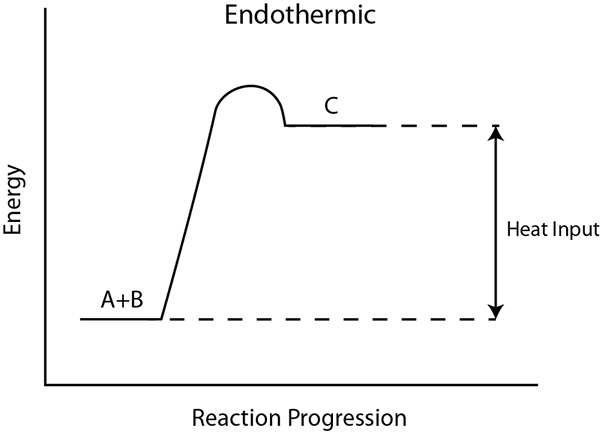
Une réaction endothermique est un processus dans lequel l'énergie est acquise de son environnement, sous forme de chaleur. Si l'environnement ne fournit pas de chaleur, la réaction ne se produit pas. Au cours de cette réaction, le récipient de réaction devient froid car il absorbe la chaleur de l'environnement environnant, abaissant ainsi la température.
Pour briser une liaison chimique, il a besoin d'énergie. Dans les réactions endothermiques, l'énergie révolutionnaire des réactifs est supérieure à l'énergie totale de formation des liaisons des produits. Par conséquent, le changement d'enthalpie est une valeur positive, et la réaction n'est pas spontanée. Par conséquent, pour les réactions endothermiques, nous devons fournir de l'énergie à l'extérieur.

Par exemple, lors de la dissolution du chlorure d'ammonium dans l'eau, le bécher fait froid car la solution absorbe l'énergie de l'environnement extérieur. La photosynthèse est une réaction endothermique qui se déroule dans l'environnement naturel. Pour la photosynthèse, la lumière du soleil fournit l'énergie requise.
Quelles sont les réactions exothermiques?
Une réaction exothermique est un processus qui libère de l'énergie à l'environnement, généralement sous forme de chaleur. De plus, l'énergie peut également se libérer sous d'autres formes telles que le son, la lumière, etc. Étant donné que l'énergie est libérée pendant la réaction, les produits contiennent moins d'énergie que les réactifs. Par conséquent, le changement d'enthalpie (∆H) devient négatif.
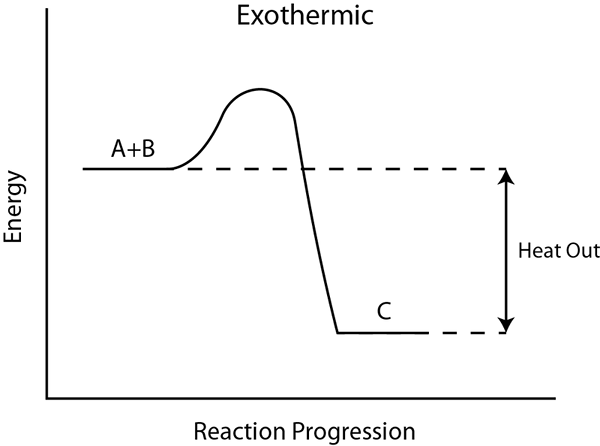
Dans ce type de réaction, l'énergie libère pendant la formation de liaisons. Si l'énergie totale de formation de liaisons est supérieure à l'énergie de rupture des liaisons pendant la réaction, alors elle est exothermique. Si l'énergie est libérée sous forme de chaleur, la température environnante augmente, de sorte que la réaction peut parfois être explosive. Les réactions exothermiques sont spontanées. Une alimentation énergétique extérieure n'est pas nécessaire pour les réactions exothermiques car ils produisent l'énergie requise à mesure que la réaction se déroule. Cependant, pour commencer la réaction, une alimentation énergétique initiale peut être nécessaire.
Si nous pouvons capturer cette énergie libérée, nous pouvons l'utiliser pour beaucoup de travail utile. Par exemple, l'énergie libérée de la combustion des carburants est utile pour faire fonctionner un véhicule ou une machine. De plus, toutes les réactions de combustion sont exothermiques.
Quelle est la différence entre les réactions endothermiques et exothermiques?
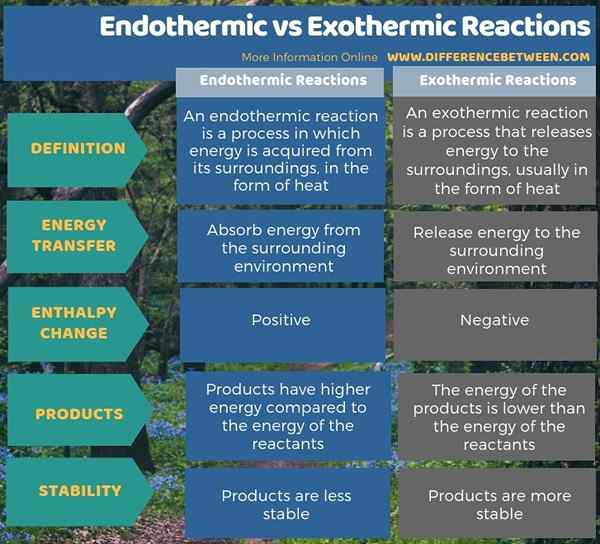
Endothermique et exothermique sont des termes liés au transfert de chaleur dans les systèmes thermodynamiques. La principale différence entre les réactions endothermiques et exothermiques est que les réactions endothermiques absorbent l'énergie de l'environnement environnant, tandis que les réactions exothermiques libèrent de l'énergie à l'environnement. De plus, le changement d'enthalpie dans un processus endothermique est positif tandis que le changement d'enthalpie dans un processus exothermique est négatif. Lorsque l'on considère le produit final, le produit d'une réaction endothermique a une énergie plus élevée par rapport à l'énergie des réactifs alors que dans les réactions exothermiques, les produits ont une énergie plus faible que l'énergie des réactifs.
Résumé - Réactions endothermiques vs exothermiques
Endothermique et exothermique sont des termes liés au transfert de chaleur dans les systèmes thermodynamiques. La principale différence entre les réactions endothermiques et exothermiques est que les réactions endothermiques absorbent l'énergie de l'environnement environnant, tandis que les réactions exothermiques libèrent de l'énergie à l'environnement.
Référence:
Helmenstine, Anne Marie. «Exemples de réaction endothermique."Thoughtco, mai. 9, 2019, disponible ici.
Image gracieuseté:
1. «Réaction endothermique» par Brazosport College - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Réaction exothermique» par Brazosport College - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


