Différence entre l'endergonique et l'exergonique
Le différence clé entre l'endergonique et l'exergonique est que Les réactions endergoniques sont non spontanées et défavorables, tandis que les réactions exergoniques sont spontanées et favorables.
L'énergie est la capacité de travailler. Dans un système, l'énergie peut faire du travail et l'énergie peut être changée en d'autres formes telles que la chaleur, le son, la lumière, etc. Lorsque l'énergie d'un système change à la suite d'une différence de température entre le système et l'environnement, nous disons que l'énergie a été transférée comme chaleur. Une réaction chimique peut être considérée comme un système. Une réaction chimique est un processus où un ou plusieurs composés sont convertis en un nouvel ensemble de composés à travers une série de changements.
Lorsque la réaction se déroule, il peut y avoir un transfert d'énergie de l'environnement vers le système ou vice versa. Certaines de ces réactions sont spontanées, et certaines ne sont pas. Toutes les réactions qui se produisent dans l'environnement ne sont pas spontanées, mais nous voyons que ces réactions non spontanées se produisent naturellement. En effet.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Endergonic
3. Qu'est-ce que l'exergonique
4. Comparaison côte à côte - Endergonique vs exergonique sous forme tabulaire
5. Résumé
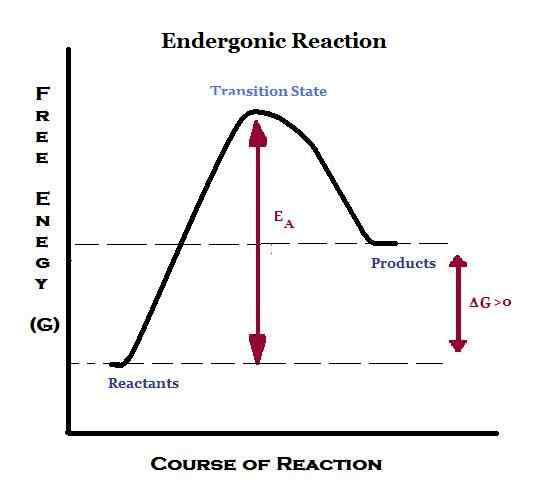
Qu'est-ce que Endergonic?
Le mot «Ender» est dérivé du mot «endo» qui signifie «à l'intérieur». Par conséquent, Endergonic signifie absorber l'énergie sous forme de travail. Par conséquent, dans une réaction endergonique, l'entourage fournit de l'énergie dans le système. De plus, les produits auront une énergie plus élevée que les réactifs. Une réaction Endegonic est considérée comme non spontanée ou défavorable. Si ce transfert d'énergie a lieu à une pression et à une température constantes, l'énergie libre standard de Gibbs sera positive. Ainsi, la constante d'équilibre pour une réaction endergonique est inférieure à.

La photosynthèse est une réaction Endegonic qui se déroule dans l'environnement naturel. Pour la photosynthèse, l'énergie est fournie par la lumière du soleil. Dans le corps humain, lorsque des réactions endergoniques ont lieu, l'énergie est fournie par l'ATP. Par conséquent, les réactions endergoniques sont associées à des réactions d'hydrolyse ATP.
Qu'est-ce que l'exergonique?
Exergonique signifie libérer de l'énergie sous forme de travail. Dans ces réactions, l'énergie est libérée du système à l'extérieur. Les réactions exergoniques sont favorables et spontanées.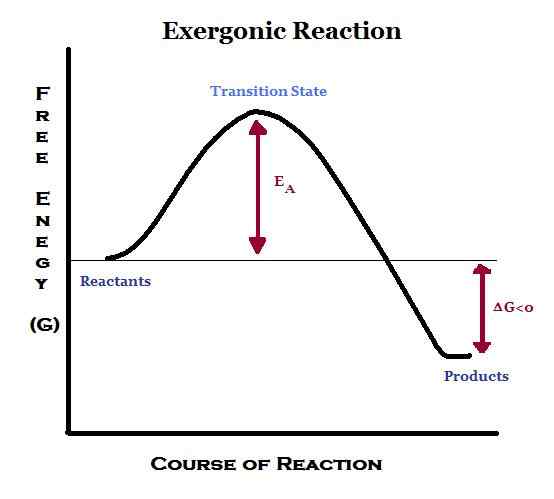
Étant donné que l'énergie est libérée pendant la réaction, les produits contiennent moins d'énergie que les réactifs. Par conséquent, le changement d'enthalpie (∆H) devient négatif. De plus, si le transfert est effectué à une pression et à une température constantes, l'énergie libre standard de Gibbs sera une valeur négative.
Quelle est la différence entre l'endergonique et l'exergonique?
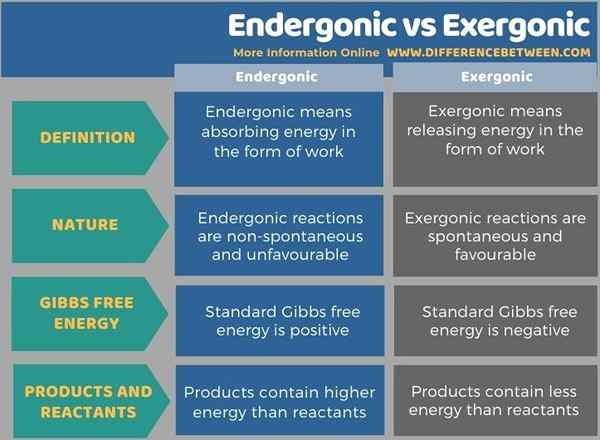
Endergonique signifie absorber l'énergie sous forme de travail tandis que l'exergonique signifie libérer l'énergie sous forme de travail. La principale différence entre l'endergonique et l'exergonique est que les réactions endergoniques sont non spontanées et défavorables, tandis que les réactions exergoniques sont spontanées et favorables. L'énergie libre standard de Gibbs sera positive dans les réactions endergoniques, contrairement aux réactions exergoniques. Dans les réactions exergoniques, les produits contiennent moins d'énergie que les réactifs mais, dans les réactions endergoniques, les produits contiennent une énergie plus élevée que les réactifs.
Résumé - Endergonique vs exergonique
Endergonique signifie absorber l'énergie sous forme de travail tandis que l'exergonique signifie libérer l'énergie sous forme de travail. La principale différence entre l'endergonique et l'exergonique est que les réactions endergoniques sont non spontanées et défavorables, tandis que les réactions exergoniques sont spontanées et favorables.
Image gracieuseté:
1. «Endergonic» par J3hoang - Propre travaux (CC By-SA 3.0) via Commons Wikimedia
2. «Exergonic» par J3hoang - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


