Différence entre l'électronégativité et la polarité
Le différence clé entre l'électronégativité et la polarité L'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui, tandis que la polarité signifie la séparation des charges.
La polarité se produit en raison des différences d'électronégativité. Par conséquent, ces deux termes sont des termes étroitement liés. Cependant, il existe une différence distincte entre l'électronégativité et la polarité. Une telle différence entre l'électronégativité et la polarité est que l'électronégativité décrit les forces d'attraction au niveau atomique tandis que la polarité décrit les forces d'attraction au niveau moléculaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'électronégativité
3. Qu'est-ce que la polarité
4. Comparaison côte à côte - électronégativité vs polarité sous forme tabulaire
5. Résumé
Qu'est-ce que l'électronégativité?
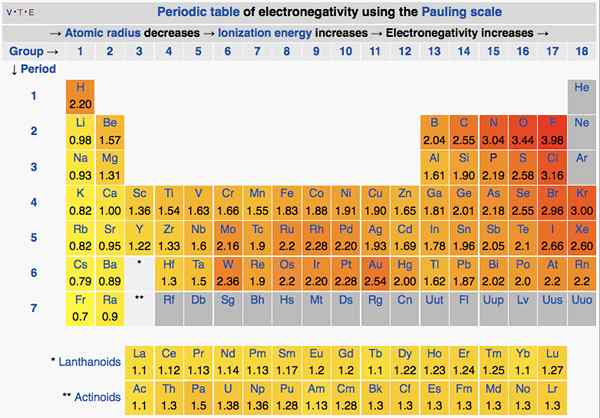
L'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui. Fondamentalement, cela montre la «ressemblance» d'un atome envers les électrons. Nous pouvons utiliser l'échelle Pauling pour indiquer l'électronégativité des éléments.
Dans le tableau périodique, l'électronégativité change selon un modèle. De gauche à droite, sur une période, l'électronégativité augmente. De haut en bas, sur un groupe, l'électronégativité diminue. Par conséquent, le fluor est l'élément le plus électronégatif avec une valeur de 4.0 sur l'échelle Pauling. Les éléments des groupes un et deux ont moins d'électronégativité; Ainsi, ils ont tendance à former des ions positifs en donnant des électrons. Étant donné que les éléments du groupe 5, 6, 7 ont une valeur d'électronégativité plus élevée, ils aiment prendre des électrons dans et en provenance d'ions négatifs.

Figure 01: électronégativité des éléments dans le tableau périodique
L'électronégativité est également importante pour déterminer la nature des liaisons. Si les deux atomes de la liaison n'ont pas de différence d'électronégativité, alors une liaison covalente se forme. Si la différence d'électronégativité entre les deux est élevée, alors une liaison ionique se formera.
Qu'est-ce que la polarité?
La polarité se produit en raison des différences d'électronégativité des atomes. Lorsque deux des mêmes atomes ou atomes ayant la même électronégativité forment une liaison entre eux, ces atomes tirent la paire d'électrons de manière similaire. Par conséquent, ils ont tendance à partager les électrons, et ce type de liaisons non polaires est connue sous le nom de liaisons covalentes. Cependant, lorsque les deux atomes sont différents, leurs électronégativités sont souvent différentes. Mais le degré de différence peut être plus élevé ou inférieur. Par conséquent, la paire d'électrons liée est tirée davantage par un atome par rapport à l'autre atome participant à la création de la liaison. Ainsi, cela entraînera une distribution inégale d'électrons entre les deux atomes. De plus, ces types de liaisons covalentes sont appelées liaisons polaires.
En raison du partage inégal d'électrons, un atome aura une charge légèrement négative, tandis que l'autre atome aura une charge légèrement positive. Dans ce cas, nous disons que les atomes ont obtenu une charge positive négative ou partielle partielle. L'atome avec une électronégativité plus élevée obtient la charge négative partielle, et l'atome avec l'électronégativité plus faible obtiendra la charge positive partielle. La polarité fait référence à la séparation des charges. Ces molécules ont un moment dipolaire.
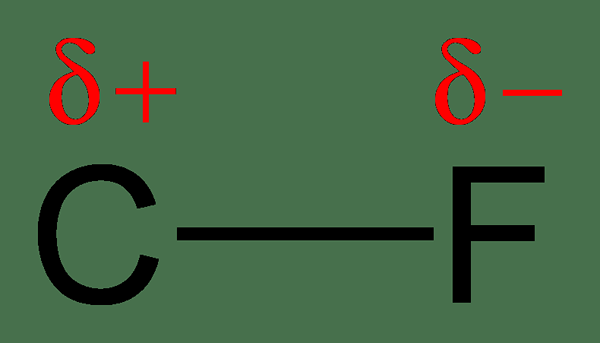
Figure 2: Séparation des charges dans la liaison C-F; Le fluor est plus électronégatif que le carbone
Dans une molécule, il peut y avoir au moins une liaison ou plus. Certaines liaisons sont polaires tandis que certains sont non polaires. Pour qu'une molécule soit polaire, toutes les liaisons doivent produire collectivement une distribution de charge inégale dans la molécule.
Molécules polaires
De plus, les molécules ont des géométries différentes, de sorte que la distribution des liaisons détermine également la polarité de la molécule. Par exemple, le chlorure d'hydrogène est une molécule polaire avec une seule liaison. La molécule d'eau est une molécule polaire avec deux liaisons. Le moment dipolaire de ces molécules est permanent car ils sont apparus en raison des différences d'électronégativité. Mais, il existe d'autres molécules qui ne peuvent être polaires qu'à certaines occasions. Une molécule avec un dipôle permanent peut induire un dipôle dans une autre molécule non polaire, alors qui deviendra également des molécules polaires temporaires. Même dans une molécule, certains changements peuvent provoquer un moment dipolaire temporaire.
Quelle est la différence entre l'électronégativité et la polarité?
L'électronégativité est une mesure de la tendance d'un atome à attirer une paire d'électrons de liaison tandis que la polarité est la propriété d'avoir des pôles ou d'être polaire. Ainsi, la principale différence entre l'électronégativité et la polarité est que l'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui, tandis que la polarité est la séparation des charges.
De plus, une différence supplémentaire entre l'électronégativité et la polarité est que l'électronégativité décrit les forces d'attraction au niveau atomique tandis que la polarité décrit les forces d'attraction au niveau moléculaire. Par conséquent, l'attraction entre le noyau atomique et les électrons les plus externes est la raison d'un atome d'avoir une valeur d'électronégativité; Ainsi, il détermine la valeur de l'électronégativité. Mais, la polarité est causée par la séparation des charges dans une obligation en raison des différences de valeurs d'électronégativité des atomes.
L'infographie ci-dessous montre plus de détails sur la différence entre l'électronégativité et la polarité.
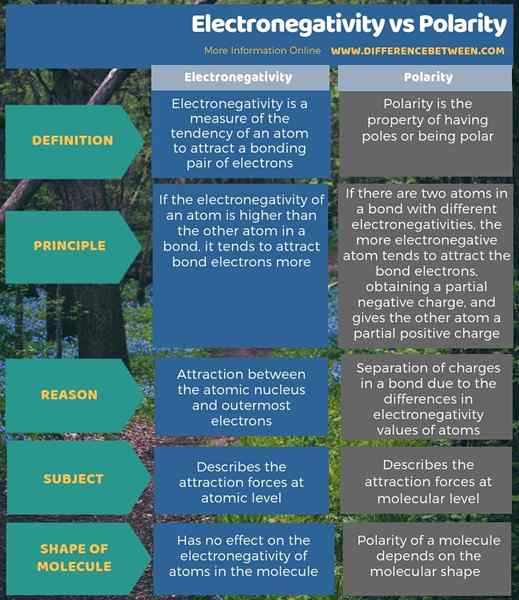
Résumé - électronégativité vs polarité
L'électronégativité et la polarité sont des termes liés; L'électronégativité des atomes dans une molécule détermine la polarité de la molécule. La principale différence entre l'électronégativité et la polarité est que l'électronégativité est la tendance d'un atome à attirer les électrons dans une liaison vers lui, tandis que la polarité signifie la séparation des charges.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemples de l'électronégativité et des exemples.”Thoughtco, oct. 17, 2018, disponible ici.
Image gracieuseté:
1. «Tableau périodique Pauling Electronegatvity» par Dmacks - (CC BY-SA 3.0) via Commons Wikimedia
2. «Carbon-fluorine-obstacle-polarity-2d» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


