Différence entre le diamant graphite et Fullerène

Le différence clé Entre Diamond Graphite et Fullerène est que Le diamant a une structure cristalline cubique en diamant et le graphite a une structure cristalline hexagonale, tandis que Fullerène se produit comme une grande molécule sphéroïdale.
Le diamant, le graphite et le fullerène sont des allotropes différents du carbone d'élément chimique. Tous ces composés n'ont que des atomes de carbone dans la composition, mais la disposition des atomes de carbone diffère les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le diamant
3. Qu'est-ce que le graphite
4. Qu'est-ce que Fullerène
5. Comparaison côte à côte - Diamond vs Graphite vs Fullerène sous forme tabulaire
6. Résumé
Qu'est-ce que le diamant?
Le diamant est un allotrope de carbone, qui a la structure cristalline cubique du diamant. Il est dans l'état solide à température et à la pression standard. De plus, il a la dureté la plus élevée parmi tous les matériaux et la plus grande conductivité thermique également. Les diamants tombent dans la catégorie des minéraux indigènes, et généralement sa couleur est jaune, marron ou gris à colorier. De plus, le clivage de ce matériau est parfait dans quatre directions, et la fracture est irrégulière. La séquence minérale d'un diamant est incolore. Lorsque vous envisagez les propriétés optiques, le diamant est isotrope.

Figure 01: Diamond
Dans ce matériau, les atomes de carbone sont SP3 hybridé. Chaque atome forme un tétraédrique avec un autre atome. Les structures tétraédriques sont rigides et les liaisons entre les atomes sont très fortes. De plus, Diamond a le plus grand nombre d'atomes dans un volume unitaire du matériau.
Qu'est-ce que le graphite?
Le graphite est un allotrope de carbone ayant la structure cristalline hexagonale. Le composé se produit naturellement sous forme de minerais de graphite; Ainsi, nous pouvons obtenir ce matériau par l'exploitation minière. C'est l'allotrope le plus stable de carbone à la température et à la pression standard. De plus, dans des conditions de température et de pression très élevées, le graphite peut se convertir en diamant. Il a une conductivité électrique élevée.

Figure 02: Graphite
Le graphite relève également de la catégorie des minéraux indigènes. La couleur peut varier du noire de fer au gris en acier. De plus, le clivage de ce matériau est basal, et la fracture est feuilletée. La dureté est très faible et il a un éclat métallique et terreux. La séquence minérale de graphite est noire. Lorsque vous envisagez les propriétés optiques, le graphite est uniaxial.
Qu'est-ce que Fullerène?
Fullerène est un allotrope de carbone qui a une grande structure sphérique. Les atomes de carbone de cet allotrope se connectent entre eux via des liaisons simples et doubles. De plus, la structure sphérique est un maillage fermé ou partiellement fermé ayant des anneaux fusionnés contenant 5 à 7 atomes de carbone. Ils sont sp2 atomes hybridés. Cependant, la structure a une souche d'angle entre les atomes.
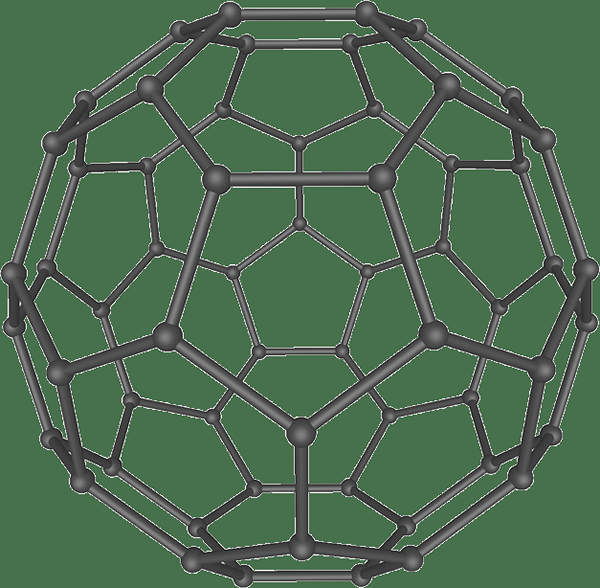
Figure 03: Structure de la sphère Fullerène
De plus, les fullerènes sont solubles dans des solvants organiques, notamment du toluène, du chlorobenzène, etc. Généralement, ce matériau est un isolant électrique.
Quelle est la différence entre Diamond Graphite et Fullerène?
Le diamant, le graphite et le fullerène sont des allotropes de carbone. La principale différence entre le diamant graphite et Fullerène est que le diamant a une structure en cristal cubique diamant et que le graphite a une structure cristalline hexagonale, tandis que Fullerène se produit comme une grande molécule sphéroïdale. De plus, le diamant est le matériau naturel le plus dur sur Terre, mais le graphite et le fullerène ont une dureté relativement faible.
De plus, une autre différence entre le diamant graphite et Fullerène est que les atomes de carbone d'un diamant sont SP3 hybridé mais, en graphite et en fullerène, ils sont sp2 hybridé. Lorsque vous envisagez la géométrie autour d'un atome de carbone, en diamant, il est tétraédrique, et en graphite, c'est un plan trigonal tandis que, à Fullerène, il est sphérique.

Résumé - Diamond vs Graphite vs Fullerène
Le diamant, le graphite et le fullerène sont des allotropes de carbone. En résumé, la principale différence entre le diamant graphite et Fullerène est que le diamant a une structure cristalline cubique diamant et que le graphite a une structure cristalline hexagonale, tandis que Fullerène se produit comme une grande molécule sphéroïdale.
Référence:
1. "Graphite.”Géologie, disponible ici.
2. "Diamant.»Wikipedia, Wikimedia Foundation, 13 juillet 2019, disponible ici.
Image gracieuseté:
1. «Vickers Anvil Diamonds» par R. Tanaka - (CC par 3.0) via Commons Wikimedia
2. «Graphite-233436» par Rob Lavinsky, Irocks.com - (cc by-sa 3.0) via Commons Wikimedia
3. «C60A» - Le téléchargeur d'origine était Mstroeck à English Wikipedia.Les versions ultérieures ont été téléchargées par Bryn C à EN.Wikipédia. - Transféré de EN.Wikipedia à Commons (CC BY-SA 3.0) via Commons Wikimedia


