Différence entre EDTA et EGTA
Edta vs egta
EDTA et EGTA sont tous deux des agents chélateurs. Les deux sont des acides carboxyliques polyamino et ont plus ou moins les mêmes propriétés.
EDTA
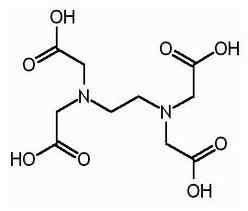
L'EDTA est le nom raccourci de l'acide tétraacétique de l'éthylène diamine. Il est également connu sous le nom d'acide tétraacétique (éthylène dinitrilo). Voici la structure de l'EDTA.

La molécule EDTA a six sites où un ion métallique peut être lié. Il y a deux groupes amino et quatre groupes carboxyles. Les deux atomes d'azote des groupes amino ont une paire d'électrons non partagée dans chacun. L'EDTA est un ligand hexadentate. Il s'agit également d'un agent chélatant en raison de la capacité de séquestrer les ions métaux. L'EDTA forme des chélates avec tous les cations sauf les métaux alcalins et ces chélates sont suffisamment stables. La stabilité résulte de plusieurs sites complexants de la molécule qui donnent naissance à une structure de type cage entourant l'ion métallique. Cela isole l'ion métallique des molécules de solvant, empêche ainsi la solvatation. Le groupe carboxyle de l'EDTA peut dissocier des protons donants; Par conséquent, l'EDTA a des propriétés acides. Les différentes espèces EDTA sont abrégées comme H4Y, h3Y-, H2Y2-, Hy3- Andy4-. À un pH très faible (milieu acide), la forme protonée de l'EDTA (H4Y) est prédominant. En revanche, à un pH élevé (milieu de base), forme entièrement déprotonée (y4-) prédomine. Et comme le pH passe de pH faible à un pH élevé, d'autres formes d'EDTA prédominent dans certaines valeurs de pH. L'EDTA est disponible sous forme de forme entièrement protonée ou de forme de sel. Disodium EDTA et Calcium Disodium EDTA sont les formes de sel les plus courantes disponibles. L'acide libre H4Y et le dihydrate du sel de sodium na2H2Y.2h2O sont disponibles dans le commerce en qualité réactif.
Lors de la dissolution dans l'eau, l'EDTA agit comme un acide aminé. Il existe comme un double zwitterion. À cette occasion, la charge nette est nulle et il y a quatre protons dissociables (deux protons sont associés aux groupes carboxyle et deux associés aux groupes amine). L'EDTA est largement utilisé comme titrant complexe. Les solutions d'EDTA sont importantes en tant que titrant car elle se combine avec des ions métalliques dans un rapport 1: 1 quelle que soit la charge sur le cation. L'EDTA est également utilisé comme conservateur pour les échantillons biologiques. Les petites quantités d'ions métalliques présents dans des échantillons biologiques et la nourriture peuvent catalyser l'oxydation de l'air des composés présents dans les échantillons. EDTA complexes étroitement ces ions métalliques, les empêchent ainsi de catalyser l'oxydation de l'air. C'est pourquoi peut être utilisé comme conservateur.
Egta
L'EGTA est le terme abrégé pour l'acide tétraacétique de l'éthylène glycol.C'est un agent chélatant, et très similaire à l'EDTA. L'EGTA a une affinité plus élevée pour les ions calcium que les ions de magnésium. Egta a la structure suivante.
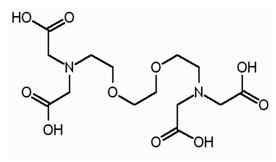
Semblable à l'EDTA, l'EGTA possède également quatre groupes carboxyle, qui peuvent produire quatre protons lors de la dissociation. Il y a deux groupes amine et les deux atomes d'azote des groupes amino ont une paire d'électrons non partagée dans chacun. L'EGTA peut être utilisé comme tampon pour ressembler au pH d'une cellule vivante. Cette propriété d'EGTA permet son utilisation dans la purification de l'affinité tandem, qui est une technique de purification des protéines.
| Quelle est la différence entre EDTA et EGTA? • L'EDTA est l'acide tétraacétique de l'éthylène diamine et l'EGTA est l'acide tétraacétique de l'éthylène glycol. • L'EGTA a un poids moléculaire plus élevé que l'EDTA. • À part les quatre groupes carboxyle, deux groupes amino, l'EGTA a également deux autres atomes d'oxygène avec des électrons non partagés. • L'EGTA a une affinité plus élevée pour les ions calcium par rapport à l'EDTA. Et l'EDTA a une affinité plus élevée pour les ions magnésium par rapport à l'EGTA. • L'EGTA a un point d'ébullition plus élevé que l'EDTA. |


