Différence entre la distillation et l'extraction
Différence clé - Distillation vs extraction
Bien que la distillation et l'extraction soient deux des méthodes de séparation physique les plus couramment utilisées ayant une importance égale dans l'industrie pour obtenir des produits chimiques purs pour de nombreuses applications, il existe une différence entre la distillation et l'extraction en fonction de leurs procédures. Le différence clé entre la distillation et l'extraction est que La distillation suit le chauffage d'un mélange liquide et la collecte de la vapeur du liquide à leur poin bouillonnantt et condensation de la vapeur pour obtenir la substance pure alors que, Dans l'extraction, un solvant approprié est utilisé pour le processus de séparation.
Qu'est-ce que la distillation?
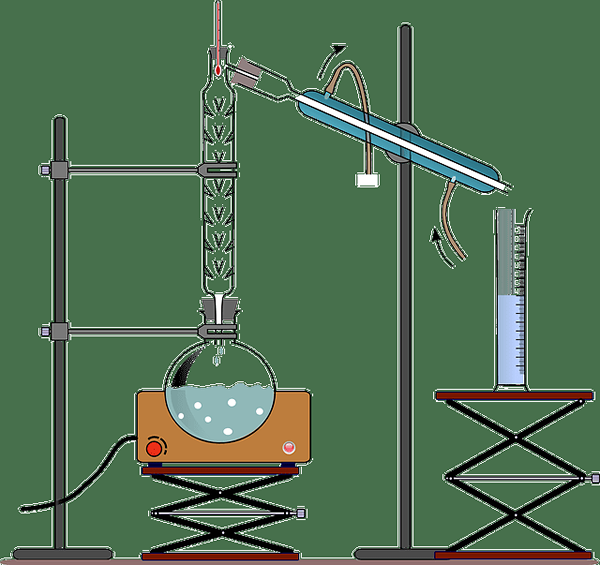
La distillation est l'une des plus anciennes méthode, mais toujours la plus utilisée pour la séparation des mélanges liquides, sur la base des différences de leurs points d'ébullition. Il comprend le chauffage d'un mélange liquide progressivement pour atteindre les points d'ébullition des liquides dans le mélange, pour obtenir leur vapeur à différents points d'ébullition et est suivi par la condensation de la vapeur pour obtenir la substance pure sous forme liquide.
Les liquides avec des points d'ébullition inférieurs (les substances les plus volatiles) sont bouillies d'abord car le mélange est chauffé tandis que des substances moins volatiles restent dans le mélange jusqu'à ce que la température du mélange atteigne leurs points d'ébullition. Un ensemble de conception spécialement des appareils est utilisé pour le processus de distillation.
Qu'est-ce que l'extraction?
Le processus d'extraction implique le retrait d'un agent actif ou d'une substance déchet. Le solvant n'est ni entièrement ni partiellement miscible avec le solide ou le liquide, mais il est miscible avec l'agent actif. L'agent actif transfère du mélange solide ou liquide au solvant par contact intensif avec le solide ou le liquide. Les phases mixtes du solvant sont séparées par des méthodes de centrifugation ou de séparation de gravité.
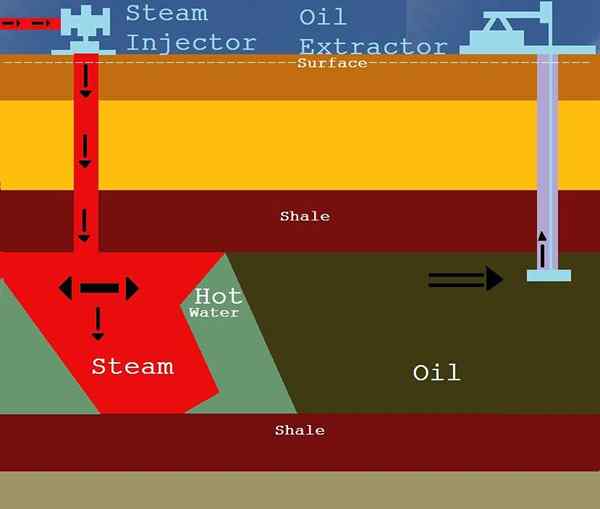
Extraction du pétrole
Quelle est la différence entre la distillation et l'extraction?
Méthodes de distillation et d'extraction
Méthode de distillation
Considérez un mélange liquide avec quatre liquides, A, B, C et D.
Points d'ébullition: BPliquide A (TUN)> Bpliquide b (TB) > BPliquide c(TC) > BPliquide d(TD)
(Composé le moins volatil) (composé le plus volatil)
Température du mélange = Tm
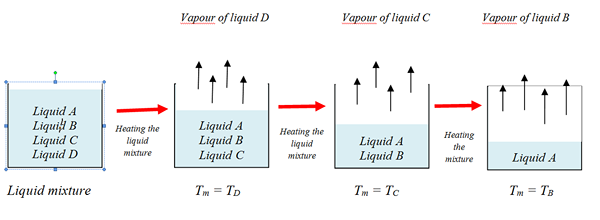
Lors du chauffage du mélange liquide, le liquide le plus volatil (D) laisse d'abord le mélange, lorsque la température du mélange est égale à son point d'ébullition (Tm = TD) tandis que d'autres liquides restent dans le mélange. La vapeur de liquide D est collectée et condensée pour obtenir du liquide pur D.
Alors que le liquide est chauffé plus loin, les autres liquides bouilla également à leurs points d'ébullition. Alors que le processus de distillation se poursuit, la température du mélange augmente.
Méthode d'extraction
Considérez une substance active A est dans le liquide B et ils sont complètement miscibles. Le solvant C est utilisé pour séparer A de B. Le liquide B et le liquide C ne sont pas miscibles.
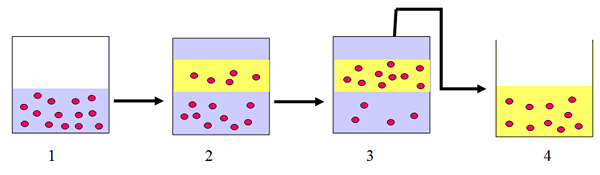
1: la substance a est dissoute dans le liquide A
2: Après avoir ajouté du solvant C, certaines des molécules du liquide A allez au solvant C
3: Au fil du temps, plus de molécules vont au solvant C. (La solubilité de A dans le solvant est supérieure à celle du liquide a)
4: Le solvant C est séparé du liquide A car ils sont non miscibles. Une autre méthode est utilisée pour isoler A du solvant.
Plusieurs extractions sont effectuées pour séparer complètement A du solvant B. La température est constante dans ce processus.
Types de distillation et d'extraction
Distillation: Les méthodes de distillation les plus couramment utilisées sont la «distillation simple» et la «distillation fractionnaire." Distillation simple est utilisé lorsque les liquides à séparer ont des points d'ébullition assez différents. Distillation fractionnée est utilisé lorsque les deux liquides à séparer possèdent presque les mêmes points d'ébullition.
Extraction: Les types d'extraction les plus couramment disponibles sont l'extraction «solide - liquide» et «Extraction liquide - liquide." Extraction solide - liquide implique la séparation d'une substance d'un solide en utilisant un solvant. Extraction liquide - liquide implique d'isoler une substance d'un liquide à l'aide d'un solvant.
Applications de la distillation et de l'extraction
Distillation: Cette méthode de séparation est utilisée dans la distillation fractionnée de l'industrie de la production de pétrole brut, des produits chimiques et du pétrole. Par exemple, séparer le benzène du toluène, de l'éthanol ou du méthanol de l'eau et de l'acide acétique de l'acétone.
Extraction: Il est utilisé pour isoler les composés organiques tels que le phénol, l'aniline et les composés aromatiques nitrés de l'eau. Il est également utile pour extraire les huiles essentielles, les produits pharmaceutiques, les saveurs, les parfums et les produits alimentaires.
Image gracieuseté: «L'extraction de l'huile à l'aide de vapeur» par MICOV à l'anglais Wikipedia. (CC BY-SA 3.0) via les communes


