Différence entre les liaisons covalentes et non covalentes
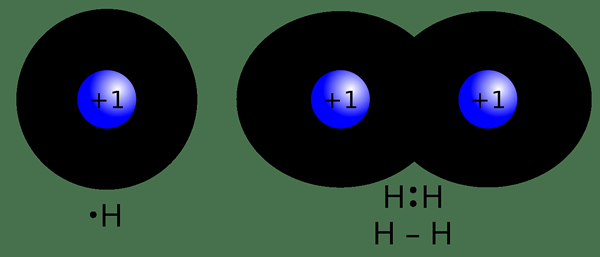
Le différence clé entre les liaisons covalentes et non covalentes est que Les liaisons covalentes se forment lorsque deux atomes partagent leurs électrons entre eux tandis que les liaisons non covalentes se forment soit en échangeant complètement des électrons entre deux atomes, soit en n'échangeant aucun électron.
Il existe quatre principaux types de liaisons chimiques: les liaisons covalentes, les liaisons ioniques, les liaisons hydrogène et les interactions van der Waals. Lorsque nous classons les liaisons chimiques comme des liaisons covalentes et non covalentes, les liaisons ioniques, hydrogène et les interactions van der Waals relèvent de la catégorie des liaisons non covalentes.
CONTENU
1. Aperçu et différence clé
2. Que sont les liaisons covalentes
3. Que sont les obligations non covalentes
4. Comparaison côte à côte - liaisons covalentes vs non covalentes sous forme tabulaire
5. Résumé
Que sont les liaisons covalentes?
Une liaison covalente est un type de liaison chimique qui se forme lorsque deux atomes partagent une paire d'électrons entre eux. Il est nommé comme une «liaison moléculaire». Ces liaisons se forment lorsque des «paires partagées» ou des «paires de liaisons» existent entre les atomes. Une obligation covalente se forme en raison de l'équilibre stable des forces attractives et répulsives entre les atomes lorsqu'ils partagent des électrons. Le partage d'électrons entre les atomes permet à chaque atome d'avoir l'équivalent d'une coque extérieure complète. Habituellement, ce type de liaison se forme entre deux atomes non métalliques ayant des valeurs d'électronégativité presque similaires ou entre un électron et un ion métallique chargé positivement.

Il existe deux principaux types de liaisons covalentes: les liaisons covalentes polaires et les liaisons covalentes non polaires. Des liaisons covalentes polaires existent entre deux atomes avec une différence entre leurs valeurs d'électronégativité dans la plage de 0.4 à 1.7. Les liaisons covalentes non polaires se forment si cette différence est inférieure à 0.4. Ici, une différence élevée entre les valeurs d'électronégativité signifie, un atome (ayant la valeur de l'électronégativité plus élevée) attire les électrons plus que l'autre atome, ce qui rend la liaison polaire.
Selon le nombre de paires d'électrons partagées entre deux atomes, nous pouvons identifier trois principaux types de liaisons covalentes en tant que liaisons uniques, qui impliquent une paire d'électrons, des liaisons doubles, qui impliquent deux paires d'électrons et une triple liaison, qui implique Trois paires d'électrons.
Que sont les obligations non covalentes?
Les liaisons non covalentes sont des liaisons chimiques qui se forment soit en échangeant complètement des électrons entre les atomes ou en n'échangeant pas du tout des électrons. Il existe trois types de liaisons non covalentes comme liaisons ioniques, liaisons hydrogène et interactions van der Waals.
Un atome peut gagner ou perdre des électrons et former des particules chargées négatives ou positives afin d'obtenir une configuration d'électrons stable. Nous appelons ces particules «ions». Ils ont des interactions électrostatiques entre eux. Un lien ionique peut être décrit comme la force d'attraction entre ces ions chargés de facturation opposés. L'interaction électrostatique entre les ions est influencée par l'électronégativité des atomes dans la liaison ionique. Par conséquent, l'électronégativité donne une mesure de l'affinité des atomes pour les électrons. Un atome à haute électronégativité peut attirer des électrons d'un atome à faible électronégativité pour former une liaison ionique.

Les liaisons hydrogène sont une autre liaison non covalente. C'est un type de force d'attraction entre deux atomes de deux molécules différentes qui est une faible force d'attraction. Cependant, en comparant avec d'autres types de forces intramoléculaires telles que les interactions polaires polaires, les interactions non polaires-nonpolaires comme les forces Vander Waal, les liaisons hydrogène sont plus fortes. Habituellement, les liaisons hydrogène se forment entre les molécules covalentes polaires. Ces molécules contiennent des liaisons covalentes polaires, qui se forment à la suite de la différence dans les valeurs d'électronégativité des atomes qui sont dans la liaison covalente.
Les interactions van der Waals sont un autre type de liaison non covalente. Ce sont des forces d'attraction faibles entre deux atomes dans deux molécules non polaires. Une interaction Van der Waals est soit une attraction induite ou une répulsion qui est causée par des corrélations dans les polarisations fluctuantes des particules voisines.
Quelle est la différence entre les liaisons covalentes et non covalentes?
Les liaisons covalentes et non covalentes sont les deux grandes classes de liaisons chimiques en chimie. Les liaisons covalentes peuvent être trouvées dans trois autres sous-groupes en tant que liaisons ioniques, liaisons hydrogène et interactions van der Waals. La principale différence entre les liaisons covalentes et non covalentes est que les liaisons covalentes se forment lorsque deux atomes partagent leurs électrons entre eux tandis que les liaisons non covalentes se forment soit en échangeant complètement des électrons entre deux atomes, soit en n'échangeant aucun électron.
Ci-dessous énumère les différences entre les liaisons covalentes et non covalentes plus en détail.

Résumé - Obligations covalentes vs non covalentes
Les liaisons covalentes et non covalentes sont les deux grandes classes de liaisons chimiques en chimie. Les liaisons covalentes peuvent être trouvées dans trois autres sous-groupes en tant que liaisons ioniques, liaisons hydrogène et interactions van der Waals. La principale différence entre les liaisons covalentes et non covalentes est que les liaisons covalentes se forment lorsque deux atomes partagent leurs électrons entre eux tandis que les liaisons non covalentes se forment soit en échangeant complètement des électrons entre deux atomes, soit en n'échangeant aucun électron.
Référence:
1. «Van der Waals Forces.”Chemistry LibreTexts, LibreTexts, 15 août. 2020, disponible ici.
Image gracieuseté:
1. «Hydrogène de liaison covalente» par Jacek FH - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «Bond ionique» par Jayron32.parler.contribs - j'ai créé ce travail entièrement par moi-même. (CC BY-SA 3.0) via Commons Wikimedia


