Différence entre le potentiel Nernst et le potentiel zeta
Le différence clé entre le potentiel de Nernst et le potentiel zêta est que Le potentiel de Nernst est donné pour une cellule biologique ou une cellule électrochimique alors que le potentiel zêta est donné pour une dispersion colloïdale.
Le potentiel de Nernst et le potentiel zêta sont des termes en chimie physique qui décrivent la différence de potentiel entre quelque chose, e.g. La membrane cellulaire, cellule électrochimique, membrane d'une particule dispersée dans un milieu de dispersion, etc.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le potentiel Nernst
3. Qu'est-ce que le potentiel Zeta
4. Comparaison côte à côte - Potentiel Nernst vs potentiel zeta sous forme tabulaire
5. Résumé
Qu'est-ce que le potentiel Nernst?
Le potentiel de Nernst ou le potentiel d'inversion est le potentiel d'une membrane cellulaire qui s'oppose à la diffusion nette d'un ion particulier à travers la membrane. Par conséquent, ce terme a des applications en biochimie. Nous pouvons déterminer le potentiel de Nernst par le rapport des concentrations de cet ion spécifique (qui essaie de traverser la membrane cellulaire) à l'intérieur de la cellule et à l'extérieur de la cellule. Cependant, ce terme est également utilisé en électrochimie, concernant les cellules électrochimiques. L'équation qui est utilisée pour déterminer le potentiel de Nernst est appelée l'équation de Nernst.
L'équation de Nernst peut être décrite comme une expression mathématique qui donne la relation entre le potentiel de réduction et le potentiel de réduction standard d'une cellule électrochimique. Cette équation a été nommée d'après le scientifique Walther Nernst. En outre, cette équation a été développée en utilisant les autres facteurs affectant les réactions électrochimiques d'oxydation et de réduction, telles que la température et l'activité chimique des espèces chimiques qui subissent l'oxydation et la réduction.
Pour obtenir l'équation de Nernst, nous devons considérer les changements standard de l'énergie libre de Gibbs qui est associée aux transformations électrochimiques qui se produisent dans la cellule. La réaction de réduction d'une cellule électrochimique peut être donnée comme suit:
Bœuf + z e- ⟶ Rouge
Dans la thermodynamique, le changement d'énergie libre réel de la réaction est,
E = eréduction - Eoxydation
Nous pouvons relier l'énergie libre de Gibbs (ΔG) à l'E (différence de potentiel) comme suit:
Δg = -nfe
Où n est le nombre d'électrons transférés entre les espèces chimiques lorsque la réaction progresse, F est la constante de Faraday. Si nous considérons les conditions standard, alors l'équation est la suivante:
ΔG0 = -Nfe0
Nous pouvons relier l'énergie libre de Gibbs des conditions non standard avec l'énergie Gibbs des conditions standard via l'équation suivante.
Δg = Δg0 + Rtlnq
Ensuite, nous pouvons remplacer les équations ci-dessus dans cette équation standard pour obtenir l'équation de Nernst comme suit:
-nfe = -nfe0 + Rtlnq
Alors l'équation de Nernst est la suivante:
E = e0 - (Rtlnq / nf)
Qu'est-ce que le potentiel Zeta?
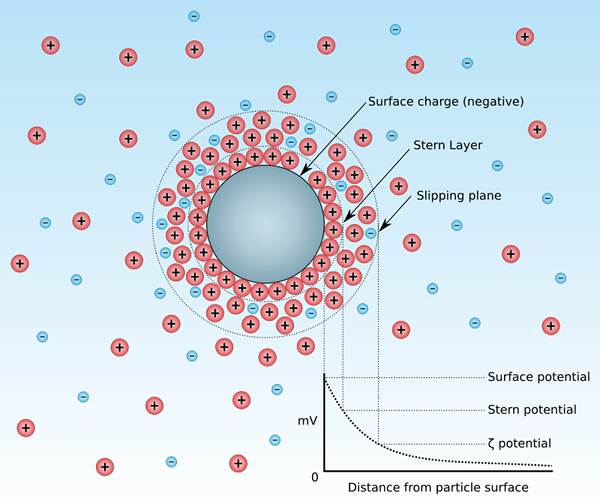
Le potentiel zêta est le potentiel électrocinétique d'une dispersion colloïdale. Ce terme vient de la lettre grecque "Zeta". Généralement, nous appelons ce potentiel de potentiel électrocinétique zêta. En d'autres termes, le potentiel zêta est la différence de potentiel entre le milieu de dispersion et la couche stationnaire du liquide attaché à la particule dispersée de la dispersion colloïdale. Cela signifie que le terme potentiel zeta nous donne une indication de la charge qui est présente sur la surface des particules. Nous pouvons reconnaître deux types de potentiel zêta: le potentiel zêta positif et négatif. De plus, ce potentiel est ce que nous mesurons comme la vitesse des particules dans un D.c. champ électrique.

Figure 01: une particule dans une suspension colloïdale
Parmi les deux types, le potentiel zêta positif indique que les particules dispersées dans la suspension dans laquelle nous mesurons le potentiel zêta ont une charge positive. De plus, lorsque nous envisageons les valeurs, il n'y a pas de différence significative entre le potentiel zêta positif et négatif.
D'un autre côté, le potentiel zêta négatif indique que les particules dispersées dans la suspension dans laquelle nous mesurons le potentiel zêta ont une charge négative; Ainsi, la charge des particules dispersées est négative.
Quelle est la différence entre le potentiel Nernst et le potentiel zeta?
Le potentiel de Nernst et le potentiel zeta sont utilisés en chimie physique. La principale différence entre le potentiel de Nernst et le potentiel zêta est que le potentiel de Nernst est donné pour une cellule biologique ou une cellule électrochimique alors que le potentiel zêta est donné pour une dispersion colloïdale.
L'infographie ci-dessous montre plus de différences entre le potentiel Nernst et le potentiel zeta.
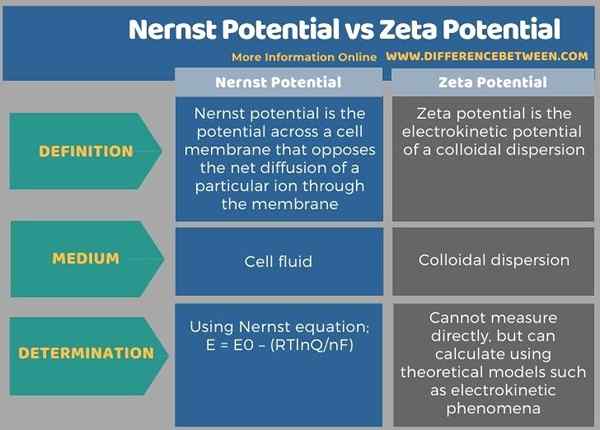
Résumé - Nernst Potential vs Zeta Potential
Les termes Nernst potentiel et le potentiel zeta sont utilisés en chimie physique. La principale différence entre le potentiel de Nernst et le potentiel zêta est que le potentiel de Nernst est donné pour une cellule biologique ou une cellule électrochimique alors que le potentiel zêta est donné pour une dispersion colloïdale.
Référence:
1. "Potentiel Zeta." Wikipédia. 23 juin 2020, disponible ici.
Image gracieuseté:
1. «Diagramme du potentiel zeta et du glissade Planev2» par modifié et converti en SVG par Mjones1984. Travail original de Larryisgood. -(CC BY-SA 3.0) via Commons Wikimedia


