Différence entre la cellule de concentration et les cellules chimiques
Le différence clé entre la cellule de concentration et les cellules chimiques est que, Dans les cellules de concentration, les compositions de deux demi-cellules sont similaires alors que dans les cellules chimiques, les compositions peuvent ou non.
La cellule de concentration est un type de cellule électrochimique. Il existe deux types de cellules électrochimiques ou de cellules chimiques comme cellules galvaniques et cellules électrolytiques. La cellule de concentration est un type de cellule galvanique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une cellule de concentration
3. Qu'est-ce qu'une cellule chimique
4. Comparaison côte à côte - cellule de concentration vs cellule chimique sous forme tabulaire
5. Résumé
Qu'est-ce qu'une cellule de concentration?
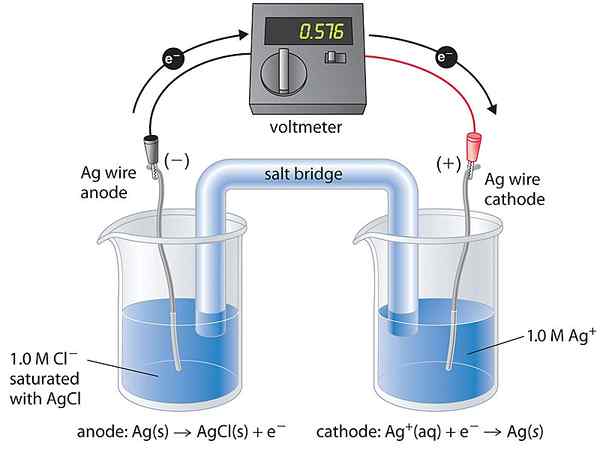
La cellule de concentration est un type de cellule galvanique dans laquelle les deux demi-cellules de la cellule sont similaires en composition. Par conséquent, nous disons que les deux demi-cellules sont équivalentes. Ils ne diffèrent que par la concentration. La tension produite par cette cellule est très petite car cette cellule a tendance à obtenir un état d'équilibre. L'équilibre vient lorsque les concentrations des deux demi-cellules deviennent égales.

La cellule de concentration produit de l'électricité via la réduction de l'énergie libre thermodynamique du système. Étant donné que la composition des demi-cellules est similaire, la même réaction se produit, mais dans des directions opposées. Ainsi, ce processus augmente la concentration de la cellule de concentration plus faible et diminue la concentration de la cellule de concentration plus élevée. Au fur et à mesure que l'électricité circule, l'énergie thermique est générée. La cellule absorbe cette énergie comme chaleur. Il existe deux types de cellules de concentration comme suit:
- Cellule de concentration d'électrolyte - Les électrodes sont constituées de la même substance, et les demi-cellules contiennent le même électrolyte avec différentes concentrations
- Cellule de concentration d'électrode - Deux électrodes (de la même substance) de concentrations différentes sont trempées dans le même électrolyte
Qu'est-ce qu'une cellule chimique
Une cellule chimique, plus précisément une cellule électrochimique, est un système (un appareil) qui peut produire de l'énergie électrique par des réactions chimiques spontanées. Les réactions chimiques impliquées dans ce processus sont appelées réactions redox. Ces réactions se produisent par le transfert d'électrons entre les espèces chimiques. De plus, une réaction redox a deux demi-réactions appelées réaction d'oxydation et réaction de réduction. Alors que les réactions d'oxydation libèrent toujours des électrons au système, les réactions de réduction prennent les électrons du système. Ainsi, nous pouvons dire que les deux demi-réactions se produisent simultanément.
Il existe deux types de cellules électrochimiques en tant que cellules voltaïques (galvaniques) et cellules électrolytiques. Une cellule électrochimique est composée de deux demi-cellules. Les demi-réactions se produisent dans ces deux demi-cellules. De plus, les réactions chimiques qui se produisent dans une cellule provoquent l'accumulation d'une différence de potentiel entre deux demi-cellules.
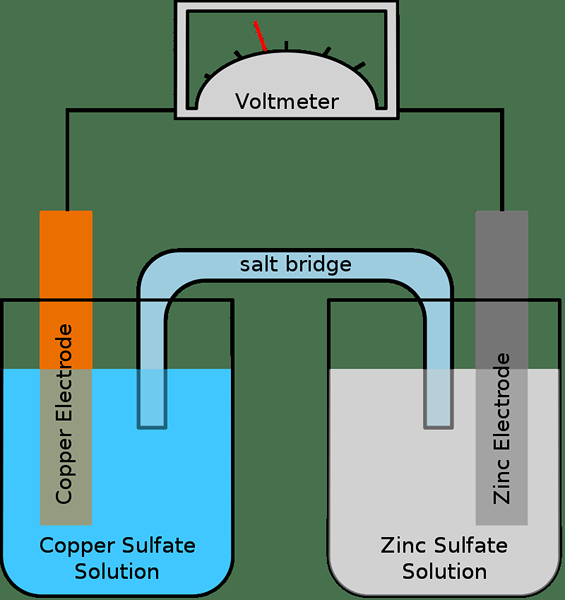
Figure 01: Une cellule galvanique simple
Une demi-cellule se compose généralement d'une électrode et d'un électrolyte. Par conséquent, une cellule électrochimique complète a deux électrodes et deux électrolytes; Les deux demi-cellules peuvent parfois utiliser le même électrolyte. S'il y a deux électrolytes différents, alors un pont de sel est utilisé pour maintenir le contact entre les électrolytes. Et cela se fait en effectuant un passage pour transférer des ions à travers le pont de sel. Les électrons s'écoulent d'une cellule de la moitié à l'autre à travers un circuit externe. Nous appelons ces deux électrodes anode et cathode.
De plus, les réactions d'oxydation et de réduction se produisent dans deux électrodes séparément. Tandis que la réaction d'oxydation se produit dans l'anode, la réaction de réduction se produit dans la cathode. Par conséquent, les électrons sont produits dans l'anode et ils se déplacent de l'anode vers la cathode à travers le circuit externe. Le pont salé aide à maintenir le système neutre (électrique) en transférant les ions à travers lui afin d'équilibrer les charges électriques.
Quelle est la différence entre les cellules de concentration et les cellules chimiques?
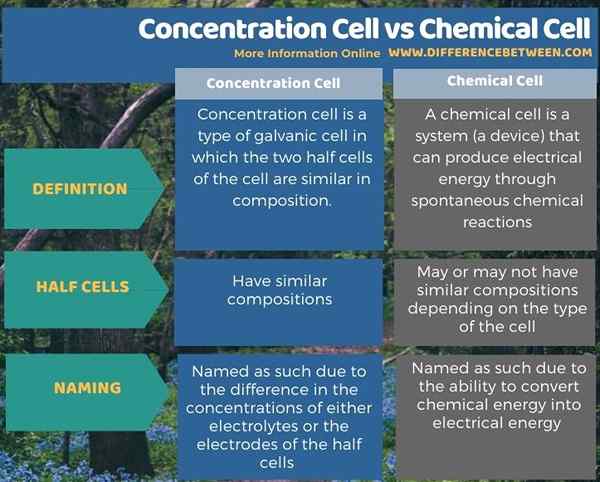
La cellule de concentration est un type de cellule électrochimique. Il existe deux types de cellules chimiques; Ce sont les cellules galvaniques et les cellules électrolytiques. La cellule de concentration est un type de cellule galvanique. La principale différence entre la cellule de concentration et les cellules chimiques est que dans les cellules de concentration, la composition de deux demi-cellules est similaire alors que dans les cellules chimiques, les compositions peuvent ou non être similaires.
Vous trouverez ci-dessous un résumé de la différence entre les cellules de concentration et les cellules chimiques.
Résumé - cellule de concentration vs cellule chimique
La cellule de concentration est un type de cellule électrochimique. Il existe deux types de cellules chimiques (électrochimiques) comme cellules galvaniques et cellules électrolytiques. Pour être précis, une cellule de concentration est un type de cellule galvanique. La principale différence entre les cellules de concentration et les cellules chimiques est que dans les cellules de concentration, la composition de deux demi-cellules est similaire alors que dans les cellules chimiques, les compositions peuvent ou non.
Référence:
1. Narendra Sriramula. «Cellule chimique.”SlideShare.filet. Disponible ici.
Image gracieuseté:
1. «Cell 3» par 473Shruthi V - propre travail (CC BY-SA 4.0) via Commons Wikimedia
2. «Galvanic Cell» par Gringer - Fichier: Galvanische Zelle.png, par tinux (cc by-sa 3.0) via Commons Wikimedia


