Différence entre les couleurs produites par les métaux alcalins et le calcium

Le différence clé entre les couleurs produites par les métaux alcalins et le calcium est que le Le calcium produit une couleur de flamme rouge orange caractéristique que les métaux alcalins ne peuvent produire.
Le test de flamme est une technique d'analyse qualitative dans laquelle nous pouvons avoir une idée d'identifier un certain élément chimique en regardant la couleur de la flamme qu'il donne lorsque nous brûlons cet élément; principalement des métaux. Cependant, nous ne pouvons pas utiliser cette technique analytique pour identifier tous les métaux que nous connaissons parce que certains métaux ne donnent pas de couleur de flamme et certains métaux ont des couleurs de flamme en commun.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les couleurs produites par les métaux alcalins
3. Quelles sont les couleurs produites par le calcium
4. Comparaison côte à côte - couleurs produites par les métaux alcalins vs calcium sous forme tabulaire
6. Résumé
Quelles sont les couleurs produites par les métaux alcalins?
Les couleurs produites par les métaux alcalins varient selon le métal. Les métaux alcalins sont les éléments chimiques du groupe 1. Les membres de ce groupe sont du lithium, du sodium, du potassium, du rubidium et du césium. Pour ces métaux du groupe 1, le test de flamme est le moyen le plus simple d'identifier le métal car ils donnent des couleurs, qui sont différentes les unes des autres. Considérons maintenant la méthode de effectuer un test de flamme.
- Nettoyez un fil de platine en le plongeant dans l'acide HCL concentré.
- Puis tenez-le dans une flamme Hot Bunsen.
- Nous devons répéter les deux étapes ci-dessus jusqu'à ce que le fil de platine ne montre aucune couleur de flamme.
- Ensuite, humidifiez le fil à nouveau dans l'acide et trempez-le dans l'échantillon du métal que nous allons tester.
- Ensuite, maintenez le fil avec l'échantillon dessus dans un brûleur à bunsen hot. Cela montre une couleur différente qui est la couleur de flamme de l'échantillon de métal

Figure 01: La couleur de la flamme de Rubidium
Lorsque nous tenons l'échantillon de métal dans la flamme, l'énergie thermique de la flamme fait passer les électrons du métal d'un niveau d'énergie à un niveau d'énergie plus élevé. Nous appelons cela «Excitation des électrons». Cependant, cette excitation est très instable. Ainsi, l'électron revient immédiatement à l'endroit où il était, libérant l'énergie comme une lumière visible. Nous reconnaissons cela comme la couleur de la flamme. De plus, la couleur donnée par des atomes plus grands a souvent une faible intensité que celle des petits atomes. Les couleurs de flamme produites par les métaux alcalins sont les suivantes:
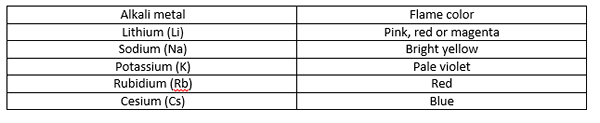
Quelles sont les couleurs produites par le calcium?
Le test de flamme pour le calcium donne une couleur rouge orange caractéristique, que tout autre métal ne peut produire.

Figure 02: Couleur de flamme du calcium
Bien que le rubidium dans le groupe métallique alcaline produit également une couleur rouge, il est distinct de la couleur du calcium principalement en raison de la différence de tailles des deux atomes (Rubidium a une coque électronique supplémentaire que l'atome de calcium; ainsi les excitations électroniques sont différentes de l'un l'autre. Il en résulte différentes couleurs de flamme).
Quelle est la différence entre les couleurs produites par les métaux alcalins et le calcium?
Les métaux alcalins produisent différentes couleurs de flamme qui facilitent l'identification d'un métal alcali. Par exemple, lithium - couleur magenta, sodium - jaune vif, potassium - violet pâle, rubidium - rouge et césium - bleu. Cependant, la couleur de la flamme produite par le calcium est différente de toutes ces couleurs; Il produit une couleur rouge orange, qui est une couleur de flamme caractéristique du calcium uniquement (aucun autre métal ne donne la même couleur). C'est la différence entre les couleurs produites par les métaux alcalins et le calcium.

Résumé - Couleurs produites par les métaux alcalins vs calcium
Différents métaux produisent une couleur de flamme différente lorsque nous les brûlons. La couleur produite par le calcium est caractéristique du calcium; Ainsi, nous pouvons le distinguer des couleurs de flamme données par les métaux alcalins. La différence entre les couleurs produites par les métaux alcalins et le calcium est que le calcium produit une couleur de flamme rouge orange caractéristique que les métaux alcalins ne peuvent pas produire.
Référence:
1. Helmenstine, Anne Marie. «Comment les couleurs de test de flamme sont produites.”Thoughtco, Thoughtco. Disponible ici
2. LibreTexts. «Tests de flamme.”Chemistry LibreTexts, LibreTexts, 17 février. 2018. Disponible ici
Image gracieuseté:
1."Die Flammenfärbung des Rubidium" par Didaktische.Medien - propre travail, (CC BY-SA 3.0) via Commons Wikimedia
2.”356886434" par Tjmwatson (CC par 2.0) via Flickr


