Différence entre chromate et dichromate

Le différence clé entre le chromate et le dichromate est que Le chromate apparaît dans une couleur jaune vif, tandis que le dichromate apparaît dans une couleur orange vif.
Le chromate et le dichromate sont des anions contenant des atomes de chrome et d'oxygène. Par conséquent, ce sont des oxyanions de chrome. Nous utilisons souvent ces termes comme termes généraux pour nommer les composés contenant ces anions. Ces deux anions ont des structures chimiques étroitement similaires; Le chromate a un anion chromate tandis que le dichromate a deux anions chromate en combinaison les uns avec les autres. Mais ils ont des apparences différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chromate
3. Qu'est-ce que le dichromate
4. Comparaison côte à côte - chromate vs dichromate sous forme tabulaire
5. Résumé
Qu'est-ce que le chromate?
Le chromate est un oxyanion du chrome ayant la formule chimique CRO42-. Généralement, nous utilisons ce terme pour nommer les composés contenant cet anion collectivement en un seul groupe, je.e. Les composés contenant l'anion chromate sont nommés chromates. Habituellement, les chromates ont une couleur jaune vif. L'atome de chrome dans cet anion est dans un état d'oxydation +6. C'est un agent oxydant modérément fort. La masse molaire de cet anion est 115.99 g / mol.
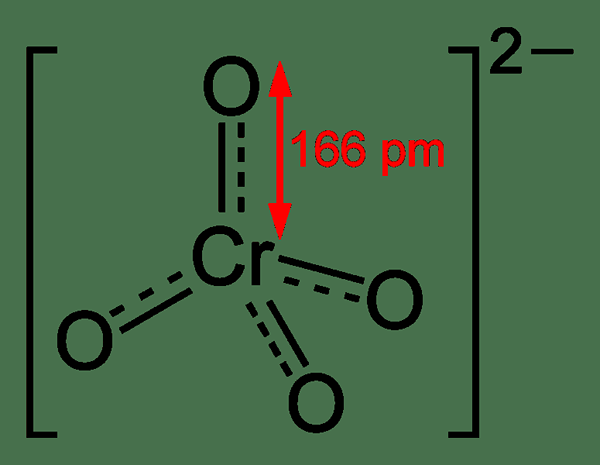
Figure 01: Structure chimique de l'ion chromate
Lorsque l'on considère les propriétés et les réactions des chromates, ils peuvent réagir avec du peroxyde d'hydrogène car l'anion de peroxyde remplace un ou plusieurs atomes d'oxygène. Dans une solution aqueuse, il y a généralement un équilibre entre le chromate et le dichromate. Cependant, nous pouvons trouver une quantité élevée de chromate à des valeurs de pH élevées (supérieures à 6.5 pH) où la quantité de dichromate est très petite. Cela signifie que dans les solutions alcalines, l'espèce prédominante est chromate.
Qu'est-ce que le dichromate?
Le dichromate est un oxyanion du chrome ayant la formule chimique Cr2O72-. Habituellement, nous utilisons ce terme pour nommer les composés contenant cet anion collectivement comme un groupe. Pour e.g., Le dichromate de potassium, le dichromate de sodium sont des dichromates. De plus, les composés contenant du dichromate comme l'anion montrent une couleur orange vif. La masse molaire de cet anion est 215.99 g / mol. Lorsque l'on considère la géométrie du dichromate, il a une géométrie tétraédrique autour de l'atome de chrome.

Figure 02: Apparence des composés de dichromate
Dans une solution aqueuse, normalement il existe un équilibre entre le chromate et le dichromate. Cependant, nous pouvons trouver une quantité élevée de dichromate et une très petite quantité de chromate à des valeurs de pH faibles (inférieures à 6.5 pH).
Quelle est la différence entre le chromate et le dichromate?
Le chromate et le dichromate sont des anions contenant des atomes de chrome et d'oxygène. Par conséquent, ce sont des oxyanions de chrome. La principale différence entre le chromate et le dichromate est que le chromate apparaît dans une couleur jaune vif, tandis que le dichromate apparaît dans une couleur orange vif. De plus, l'ion chromate a un atome de chrome par anion tandis que l'ion dichromate a deux atomes de chrome par anion.
De plus, une autre différence entre le chromate et le dichromate est dans leur masse molaire. La masse molaire de l'anion dichromate est 215.99 g / mol tandis que la masse molaire de l'anion chromate est 115.99 g / mol. Dans une solution aqueuse, il y a normalement un équilibre entre le chromate et le dichromate. Cependant, nous pouvons trouver une quantité élevée de chromate à des valeurs de pH élevées (supérieures à 6.5 pH) où la quantité de dichromate est très petite. Mais à de faibles valeurs de pH (inférieure à 6.5 pH), il y a plus d'ions dichromate.

Résumé - Chromate vs dichromate
Le chromate et le dichromate sont des anions contenant des atomes de chrome et d'oxygène. Par conséquent, ce sont des oxyanions de chrome. La principale différence entre le chromate et le dichromate est que le chromate apparaît dans une couleur jaune vif tandis que le dichromate apparaît dans une couleur orange vif. Dans une solution aqueuse, normalement il existe un équilibre entre le chromate et le dichromate. Cependant, nous pouvons trouver une quantité élevée de chromate à des valeurs de pH élevées (supérieures à 6.5 pH), tandis que dans de faibles valeurs de pH (inférieure à 6.5 pH), il y a plus d'ions dichromate.
Référence:
1.«Dichromate.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
2."Dichromate de potassium.»Wikipedia, Wikimedia Foundation, 9 novembre. 2019, disponible ici.
3. Cheremisinoff, Paul N. «Traitement de l'exemple de l'industrie des engrais effluents.”Minimisation des déchets et réduction des coûts pour le processus Industries, 1995, pp. 285-324., doi: 10.1016 / B978-081551388-9.50010-5.
Image gracieuseté:
1. «Chromate-2d-dimensions» par Ben Mills - propre travail (domaine public) via Commons Wikimedia
2. «Potassium-dichromate-échantillon» par Benjah-BMM27 - propre travail (domaine public) via Commons Wikimedia


