Différence entre le chlorite et le chlorure
Le différence clé entre le chlorite et le chlorure Est-ce que l'ion chlorite est un agent fortement oxydant, alors que le chlorure n'est pas un agent oxydant.
Le chlorite et le chlorure sont des anions dérivés des atomes de chlore. Ces anions peuvent augmenter leurs états d'oxydation lors d'une réaction chimique, mais seuls l'ion chlorite peut réduire son état d'oxydation en outre, tandis que l'ion chlorure ne peut pas. Par conséquent, le chlorite est un agent oxydant, mais l'ion chlorure n'est pas.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorite
3. Qu'est-ce que le chlorure
4. Comparaison côte à côte - chlorite vs chlorure sous forme tabulaire
5. Résumé
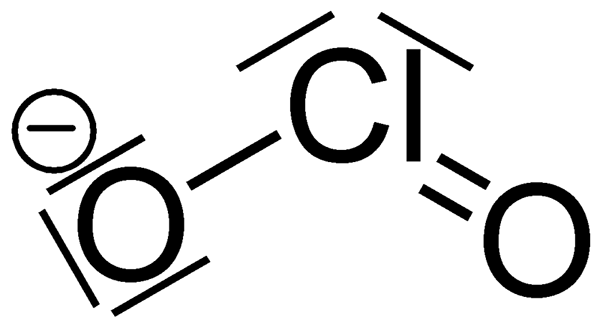
Qu'est-ce que le chlorite?
Le chlorite est un anion ayant la formule chimique CLO2-. La masse molaire de cet anion est 67.45 g / mol. Il est également connu sous le nom d'anion de dioxyde de chlore, et c'est un exemple d'halite. Les composés de chlorite sont des composés chimiques qui contiennent cet anion; Le chlore est à l'état d'oxydation +3. Les chlorites sont les sels de l'acide chlorant.
Lorsque l'on considère la chimie de l'ion chlorite, il a une géométrie moléculaire courbée en raison de l'effet des paires d'électrons solitaires sur les atomes de chlore. L'angle de liaison de la liaison O-Cl-O est d'environ 111 degrés. De plus, le chlorite est l'agent oxydant le plus fort parmi les autres oxyanions du chlore, selon le potentiel de demi-cellule.
L'application la plus courante de chlorite est son sel de sodium (chlorite de sodium) qui est utile dans le blanchiment du textile, de la pulpe et du papier en raison de sa nature fortement oxydante. Cependant, il n'est pas utilisé directement, et à la place, nous devons générer les espèces de dioxyde de chlore neutre via la réaction avec HCL.
Qu'est-ce que le chlorure?
Le chlorure est l'anion ayant la formule chimique CL-. Cet anion dérive d'un atome de chlore. En règle générale, un atome de chlore est composé de 17 électrons, et il a une configuration d'électrons instable en raison du remplissage orbital incomplet. Par conséquent, les atomes de chlore sont très réactifs et forment des ions de chlorure en obtenant un électron de l'extérieur. Cet électron entrant occupe l'orbitale la plus externe de l'atome de chlore. Mais il n'y a pas assez de charges positives dans le noyau du chlore pour neutraliser la charge négative de cet électron. Par conséquent, il forme un anion appelé chlorure ion. Un exemple courant d'un composé contenant un ion de chlorure est le sel de table ou le chlorure de sodium.
L'ion chlorure a 18 électrons. La configuration électronique est similaire à celle d'un atome d'argon. Il est moins réactif, et son électronégativité est également très moins. Il a tendance à repousser tout autre électron entrant en raison de sa charge négative.
Les composés qui contiennent des ions chlorure sont généralement appelés chlorures. La plupart de ces chlorures sont solubles dans l'eau. Lorsque ces composés sont dissous dans l'eau, l'anion et les cations sont séparés les uns des autres. Étant donné que ces ions sont des ions chargés électriquement, une solution composée d'ions chlorure et de tout autre cation peut mener un courant électrique à travers la solution.
Différence entre le chlorite et le chlorure
Le chlorite et le chlorure sont des anions dérivés des atomes de chlore. Le chlorite est un anion ayant la formule chimique CLO2- tandis que le chlorure est l'anion ayant la formule chimique CL-. Le chlorite est un oxyanion et contient des atomes d'oxygène en dehors du chlore. La principale différence entre le chlorite et le chlorure est que l'ion chlorite est un agent fortement oxydant, alors que le chlorure n'est pas un agent oxydant mais il peut agir comme un agent réducteur.
Vous trouverez ci-dessous un résumé de la différence entre le chlorite et le chlorure sous forme tabulaire.
Résumé - chlorite vs chlorure
Le chlorite et le chlorure sont des anions dérivés des atomes de chlore. La principale différence entre le chlorite et le chlorure est que l'ion chlorite est un agent fortement oxydant, alors que le chlorure n'est pas un agent oxydant.
Référence:
1. «Halogènes en tant qu'agents oxydants." Chemistry LibreTexts, LibreTexts.
Image gracieuseté:
1. «Chlortion» par Eschenmoser - Propre travaux en utilisant: Chemdraw 8.0 (domaine public) via les communes Wikimedia


