Différence entre le chlore et l'hypochlorite de sodium

Le différence clé entre le chlore et l'hypochlorite de sodium est que le chlore (CL2) est un gaz de couleur jaune pâle tandis que l'hypochlorite de sodium (Naocl) est un solide jaune verdâtre à température ambiante.
Le chlore et l'hypochlorite de sodium sont des composés chimiques de l'élément chimique chlore (CL). Le terme chlore décrit chimiquement l'élément chimique, mais en commun, c'est le nom du chlore gazeux, que nous utilisons à des fins de nettoyage. L'hypochlorite de sodium, en revanche, est un blanchissement liquide commun.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlore
3. Qu'est-ce que l'hypochlorite de sodium
4. Comparaison côte à côte - chlore vs hypochlorite de sodium sous forme tabulaire
5. Résumé
Qu'est-ce que le chlore?
Le chlore est un gaz à température ambiante ayant la formule chimique CL2. Il a une apparence de couleur jaune pâle, et c'est un agent extrêmement réactif. Par conséquent, il peut agir comme un fort agent oxydant. En dehors de cela, ce gaz a une odeur piquante et irritante similaire à Bleach que nous utilisons normalement. Dans la nomenclature de l'IUPAC, nous nommons ce composé comme du chlore moléculaire.
La masse molaire de ce composé est 70.9 g / mol. La molécule de chlore gazeux contient deux atomes de chlore liés l'un à l'autre via une liaison chimique covalente. Par conséquent, nous l'appelons comme une molécule diatomique. De plus, ce gaz est légèrement soluble dans l'eau. Nous pouvons également liquéfier ce gaz à environ -35 ° C. Ou bien nous pouvons le liquéfier en appliquant une pression externe pour comprimer le gaz à température ambiante. Le chlore gazeux est inflammable, mais il peut aider à la combustion.

Figure 01: chlore liquéfié
L'inhalation de chlore gaze est toxique. Il agit également comme un irritant à l'œil. En plus de cela, ce gaz est plus lourd que l'air normal. Par conséquent, il s'accumule facilement dans l'atmosphère inférieure. Puisqu'il existe sous forme de gaz à température ambiante, les points de fusion et d'ébullition sont respectivement de -101 ° C et -35 ° C. Lorsque vous envisagez les utilisations de ce gaz, il y a trois utilisations majeures; Sanitation, désinfection et applications antiseptiques. De plus, certaines personnes l'utilisent également comme une arme chimique.
Qu'est-ce que l'hypochlorite de sodium?
L'hypochlorite de sodium est un composé inorganique ayant la formule chimique naocl. C'est un solide jaune verdâtre à température ambiante. La molécule contient un cation sodium et un anion hypochlorite. Ces deux ions sont liés les uns aux autres via des interactions électrostatiques. De plus, nous pouvons classer ce composé comme un sel de sodium d'acide hypochloré, en considérant la molécule parent du composé; La molécule parent est de l'acide hypochlore.
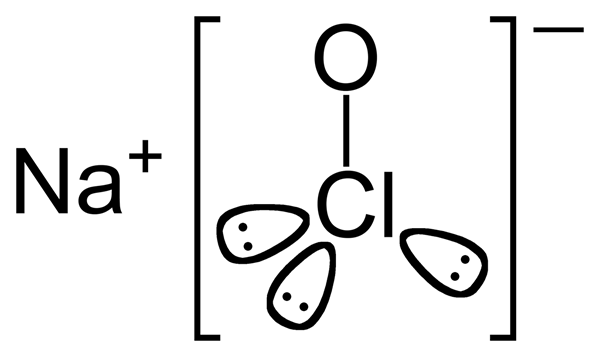
Figure 02: molécule d'hypochlorite de sodium
La masse molaire est de 74.44 g / mol. Il a une odeur de chlore. Pourtant, il a une douce odeur. Puisqu'il existe en tant que solide à température ambiante, les points de fusion et d'ébullition sont des valeurs positives; Les points de fusion et d'ébullition sont respectivement de 18 ° C et 101 ° C.
Souvent, nous nommons une solution jaune verdâtre comme l'hypochlorite de sodium car cette solution fabriquée à partir de la dissolution du solide dans l'eau donne le blanchiment liquide commun que nous utilisons dans le ménage. De plus, le composé solide est instable. Ainsi, il peut se décomposer explosivement. Nous pouvons cristalliser ce composé comme son pentahydrate. Ce composé hydraté est très stable; Ainsi, nous pouvons le conserver dans un réfrigérateur. Dans sa forme de blanchiment liquide, le composé chimique de la solution libère du chlore gazeux. Cependant, ce composé chimique n'est pas aussi toxique ou corrosif comme le chlore gazeux. Les principales utilisations de ce composé comprennent le blanchiment, le nettoyage, la désinfection, la désodorisation, les traitements des eaux usées, etc.
Quelle est la différence entre le chlore et l'hypochlorite de sodium?
Le chlore est un gaz à température ambiante qui a la formule chimique CL2 tandis que l'hypochlorite de sodium est un composé inorganique ayant la formule chimique naocl. C'est la différence fondamentale entre le chlore et l'hypochlorite de sodium. Les deux sont importants en tant qu'agents de blanchiment, désinfectants, etc. Lorsque l'on considère la liaison chimique, la différence entre le chlore et l'hypochlorite de sodium est que le chlore a une liaison chimique covalente entre deux atomes de chlore tandis que l'hypochlorite de sodium a une force d'attraction électrostatique entre le cation sodium et l'hypochlorite anion. Nous pouvons considérer leurs apparences comme la principale différence entre le chlore et l'hypochlorite de sodium. Le chlore est un gaz de couleur jaune pâle tandis que l'hypochlorite de sodium est un solide jaune verdâtre à température ambiante. De plus, le chlore gaz est très toxique par rapport à la toxicité de l'hypochlorite de sodium.
L'infographie ci-dessous fournit plus d'informations sur la différence entre le chlore et l'hypochlorite de sodium.
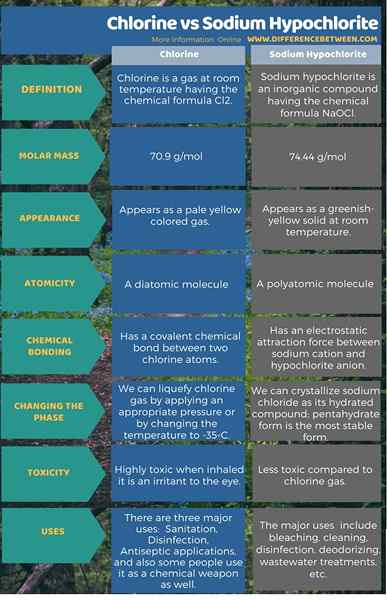
Résumé - chlore vs hypochlorite de sodium
Le chlore gazeux et l'hypochlorite de sodium sont importants en tant qu'agents de blanchiment et désinfectants. Le chlore gazeux lui-même est oxydatif tandis que l'hypochlorite de sodium peut libérer le chlore gazeux pour ses applications. La principale différence entre le chlore et l'hypochlorite de sodium est que le chlore est un gaz de couleur jaune pâle tandis que l'hypochlorite de sodium est un solide de jaune verdâtre à température ambiante.
Référence:
1. "L'hypochlorite de sodium.»Wikipedia, Wikimedia Foundation, 9 septembre. 2018. Disponible ici
2. "Chlore.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
Image gracieuseté:
1.«Liquid Pool Chlorin» par Maksym Kozlenko - Propre travaux, (CC BY-SA 4.0) via Commons Wikimedia
2.«Sodium-Hypochlorite» par Benjah-Bmm27 - Propre travaux, (domaine public) via Commons Wikimedia


