Différence entre les chaperons et les chaperonins
Le différence clé entre les chaperons et les chaperonins est que Les chaperons remplissent un large éventail de fonctions, notamment le pliage et la dégradation de la protéine, aidant dans l'assemblage des protéines, etc., tandis que la fonction clé des chaperonines est d'aider au pliage des grandes molécules de protéines.
Les chaperons ou chaperons moléculaires sont des molécules de protéines qui aident au processus de pliage des protéines en structures complexes. Par conséquent, les chaperonins sont un type de chaperon, qui comprend des protéines de choc thermique. De tous les types de chaperons, les chaperonins sont les protéines les plus étudiées en raison du rôle important qu'il joue lors du pliage des protéines correctes. Par conséquent, l'action des chaperons et des chaperonines empêchent l'agrégation irréversible des protéines et permettant ainsi leur fonctionnalité. Les chaperons et les chaperonines diffèrent minutieusement en fonction de la fonctionnalité des deux molécules.
CONTENU
1. Aperçu et différence clé
2. Que sont les chaperons
3. Que sont les chaperonins
4. Similitudes entre les chaperons et les chaperonins
5. Comparaison côte à côte - chaperons vs chaperonins sous forme tabulaire
6. Résumé
Que sont les chaperons?
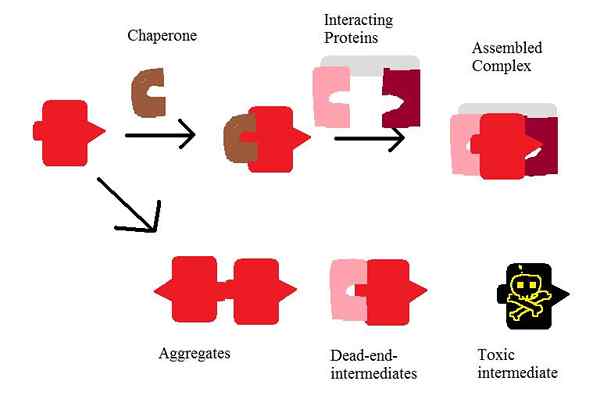
Les chaperons sont des protéines qui aident à l'assemblage des protéines, le repliement des protéines et dans le processus de dégradation des protéines. Par conséquent, il existe de nombreuses classes de chaperons moléculaires. Les chaperons qui se lient aux surfaces hydrophobes des protéines facilitent le repliement et empêchent une agrégation irréversible de protéines. De plus, les chaperons peuvent être classés en différentes classes en fonction de la taille et du compartiment cellulaire. Les chaperonins sont l'une des classes les plus importantes de chaperons, qui sont des protéines de choc thermique.

Figure 01: Action de chaperon
De plus, des chaperons sont nécessaires pour le processus de dégradation des protéines. Lorsque les protéines subissent un mauvais repliement, les chaperons sont impliqués dans le processus d'ubiquitination conduisant à la destruction de la protéine.
Que sont les chaperonins?
La chaperonine est une classe de chaperons qui sont spécifiquement impliqués dans le pliage de grandes protéines. Ils ont une structure spécifique. Les chaperonins comprenaient une structure de deux anneaux qui peut être homo - dimère ou hétéro - dimère. Ces deux structures d'anneaux forment deux cavités centrales. Chaque sous-unité a un domaine qui peut se lier à la surface hydrophobe de la protéine. Une fois que la liaison a lieu, les chaperonines apportent un changement conformationnel dans la protéine. Cela permet le pliage correct de la protéine.

Figure 02: Chaperonins
Il existe deux grandes catégories de chaperonins à savoir les chaperonins du groupe I et les chaperonins du groupe II. Les chaperonines du groupe I sont procaryotes et comprennent principalement les protéines bactériennes de choc thermique telles que Hsp60 et procaryote GroEL. Les chaperonins du groupe II comprennent les chaperonins archéens et eucaryotes. Certains des chaperonines du groupe II sont un polypeptide et des groes liés à la complexe T.
Quelles sont les similitudes entre les chaperons et les chaperonins?
- Les chaperons et les chaperonines sont des protéines.
- Ils sont principalement impliqués dans le pliage des protéines.
- Les deux se lient aux régions hydrophobes de la protéine.
- Ils peuvent être synthétisés in vitro et peut être utilisé dans de nombreuses recherches liées au mauvais repliement des protéines.
Quelle est la différence entre les chaperons et les chaperonins?
Les chaperons sont des protéines qui impliquent dans le repliement, la dégradation et l'assemblage des protéines. Ainsi, il existe plusieurs sous-classes de chaperons basées sur le mécanisme d'action. Certains impliquent dans le repliement des protéines tandis que certains impliquent une solubilisation des protéines agrégées. D'un autre côté, les chaperonins sont un type de chaperons, qui impliquent spécifiquement dans le pliage des protéines. C'est la principale différence entre les chaperons et les chaperonins. De plus, il existe deux groupes de chaperonins; Chaperonins du groupe I et chaperonins du groupe II.
L'infographie ci-dessous présente la différence entre les chaperons et les chaperonins sous forme tabulaire.
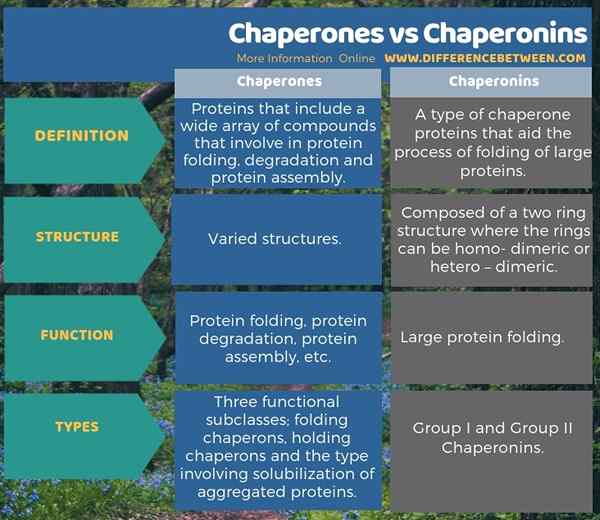
Résumé - chaperons vs chaperonins
Les chaperons sont une large classe de biomolécules, qui sont des protéines. Ils aident au repliement des protéines, à la dégradation et à l'assemblage des protéines. Les chaperonins sont une classe de chaperons qui fonctionnent spécifiquement dans le repliement des grandes protéines. Par conséquent, la différence clé entre les chaperons et les chaperonines est basée sur la fonction des deux protéines. Ils diffèrent également par la structure. Les chaperons varient en structure tandis que les chaperonins ont une structure spécifique à deux sonneries.
Référence:
1.Slavotinek, A M et L G Biesecker. «Dépliement du rôle des chaperons et des chaperonines dans les maladies humaines." Progrès en pédiatrie., U.S. Bibliothèque nationale de médecine, sept. 2001. Disponible ici
Image gracieuseté:
1.«Protéines membranaires en complexes» par MedievalPacman - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Groes-Groel Top» sans aucun auteur lisible par machine fourni. (Domaine public) via Commons Wikimedia


