Différence entre le sulfate de calcium et le plâtre de Paris
Le différence clé entre le sulfate de calcium et le plâtre de Paris Le sulfate de calcium est un composé inorganique ayant un cation calcique et un anion sulfate, tandis que le plâtre de Paris est un matériau contenant des hémihydrates de sulfate de calcium.
Le terme sulfate de calcium est courant dans les laboratoires de chimie, tandis que le terme plâtre de Paris est courant dans les laboratoires médicaux et le talent artistique. C'est parce que le plâtre de Paris est un matériau qui peut être utilisé pour la moulure.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le sulfate de calcium
3. Qu'est-ce que le plâtre de Paris
4. Comparaison côte à côte - sulfate de calcium vs plâtre de Paris sous forme tabulaire
6. Résumé
Qu'est-ce que le sulfate de calcium?
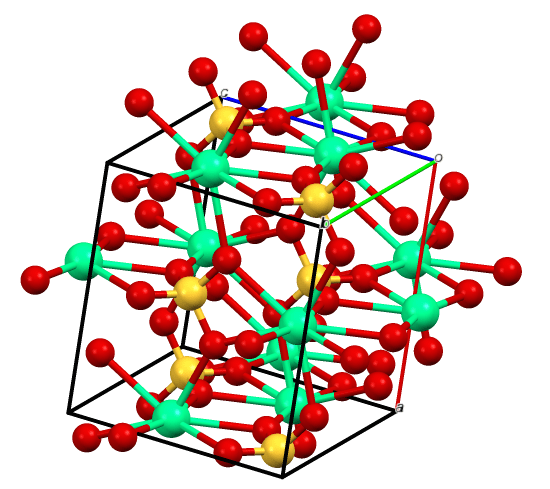
Le sulfate de calcium est un composé inorganique ayant la formule chimique caso4. Il se produit généralement sous ses formes hydratées. De plus, la masse molaire du sulfate de calcium anhydre est de 136.14 g / mol. Il apparaît comme un solide blanc à température ambiante. De plus, ce solide blanc est inodore.

Figure 01: Structure chimique du composé ionique du sulfate de calcium
La principale source de sulfate de calcium est le gypse, un minéral naturel. Une autre source importante est l'anhydrite. Ces deux dépôts se produisent à mesure que. De plus, nous pouvons obtenir le minéral via deux voies: via une carrière à casting ouvert ou via une mine profonde. En plus de cela, nous pouvons obtenir du sulfate de calcium comme sous-produit de nombreux processus différents, tels que la désulfurisation des gaz de combustion, la production d'acide phosphorique à partir de roches de phosphate, la production de fluorure d'hydrogène, etc. De plus, lorsque le sulfate de calcium est produit, nous pouvons l'observer à trois étapes différentes: forme anhydre, forme dihydratée et forme hémihydrate.
De plus, il existe différentes utilisations du sulfate de calcium. Il est utile dans la production de plâtre de Paris, la production de stuc, dans l'industrie alimentaire en tant que coagulants, etc. Il est également utilisé comme agent rafraîchissant, un agent de levain, et comme dessiccant dans différentes applications.
Qu'est-ce que le plâtre de Paris?
Nous pouvons produire du plâtre de Paris à partir de gypse. Les gens ont utilisé ce matériel des temps anciens. Les personnes vivant dans des régions près de Paris ont largement utilisé ce matériel, pour faire du plâtre et du ciment. Ils l'ont également utilisé pour faire des travaux ornementaux sur les plafonds et les corniches. C'est donc ainsi que le nom de plâtre de Paris a vu le jour. Le plâtre de Paris contient les hémihydrates de sulfate de calcium (Caso4· 0.5h2O).

Figure 02: Hémihydrate de sulfate de calcium / plâtre de Paris
De plus, nous pouvons préparer ce composé en chauffant le gypse, qui contient du sulfate de calcium (CASO4· 2h2O), à une température d'environ 150 ° C (120-180 ° C). Au-dessus de cela, nous devons ajouter certains additifs lors du chauffage.
D'ailleurs, le plâtre de Paris est une fine poudre blanche. Lorsqu'il devient hydraté, nous pouvons l'utiliser pour modeler les choses, et si nous le permettons de sécher, il durcit et conserve la forme avant le séchage.
Quelle est la différence entre le sulfate de calcium et le plâtre de Paris?
Le sulfate de calcium est un composé inorganique ayant la formule chimique caso4, Mais le plâtre de Paris contient du sulfate de calcium. La principale différence entre le sulfate de calcium et le plâtre de Paris est que le sulfate de calcium est un composé inorganique ayant un cation calcique et un anion sulfate, tandis que le plâtre de Paris est un matériau contenant des hémihydrates de sulfate de calcium.
L'infographie ci-dessous fournit une description détaillée de la différence entre le sulfate de calcium et le plâtre de Paris.

Résumé - Sulfate de calcium vs plâtre de Paris
Le plâtre de Paris contient du sulfate de calcium. La principale différence entre le sulfate de calcium et le plâtre de Paris est que le sulfate de calcium est un composé inorganique ayant un cation calcique et un anion sulfate, tandis que le plâtre de Paris est un matériau contenant des hémihydrates de sulfate de calcium.
Référence:
1. Alden, Andrew. «Apprenez à connaître les 7 minéraux de sulfate délicats."Thoughtco, février. 11, 2020, disponible ici.
2. "Sulfate de calcium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «Caso4» par Smokefoot - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Hémihydrate de sulfate de calcium» (domaine public) via les communes Wikimedia


