Différence entre le lactate de calcium et le carbonate de calcium
Le différence clé entre le lactate de calcium et le carbonate de calcium est que le Le lactate de calcium contient deux ions de lactate pour chaque ion calcique tandis que le carbonate de calcium contient un ion carbonate par chaque ion calcique. De plus, ils diffèrent également dans l'application.
Le lactate de calcium et le carbonate de calcium sont des sels inorganiques. Ces deux composés sont utiles comme suppléments de calcium pour traiter les faibles niveaux sanguins de calcium pour les personnes qui n'obtiennent pas suffisamment de calcium de leur alimentation. Discutons de plus de détails sur ces composés et distinguons ainsi la différence entre le lactate de calcium et le carbonate de calcium.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le lactate de calcium
3. Qu'est-ce que le carbonate de calcium
4. Comparaison côte à côte - lactate de calcium vs carbonate de calcium sous forme tabulaire
5. Résumé
Qu'est-ce que le lactate de calcium?
Le lactate de calcium est un sel inorganique ayant la formule chimique C6HdixCao6. Il contient deux ions lactate par chaque cation calcique. La masse molaire est 218.22 g / mol, et il apparaît comme une poudre blanche ou blanche. Son point de fusion est de 240 ° C. De plus, l'anion lactate a une chiralité; Ainsi, il a des isomères D et L. Habituellement, les organismes vivants synthétisent et métabolisent l'isomère L. Cependant, certaines bactéries peuvent également synthétiser l'isomère D. De plus, ce composé forme plusieurs hydrates; L'hydrate le plus courant est la forme pentahydrate.
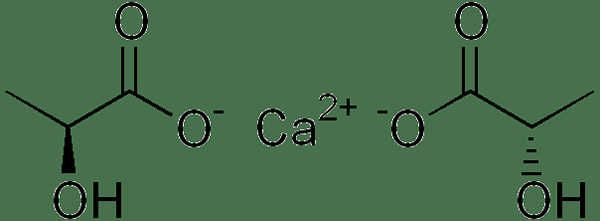
Figure 01: Structure chimique du lactate de calcium
Nous pouvons produire du lactate de calcium via la réaction de l'acide lactique avec du carbonate de calcium (ou de l'hydroxyde de calcium). Dans la production à l'échelle industrielle, la stratégie de production commune est la fermentation des glucides en présence de carbonate de calcium ou d'hydroxyde.
Les principales applications de ce composé sont en médecine; il est utilisé comme antiacide. De plus, il est utile de traiter l'hypocalcémie (le terme médical pour une carence en calcium). Nous n'avons pas à prendre ce composé avec de la nourriture parce que notre corps peut absorber ce composé à différentes valeurs de pH. En plus de cela, nous pouvons également trouver ce composé dans divers bains de bouche.
Qu'est-ce que le carbonate de calcium?
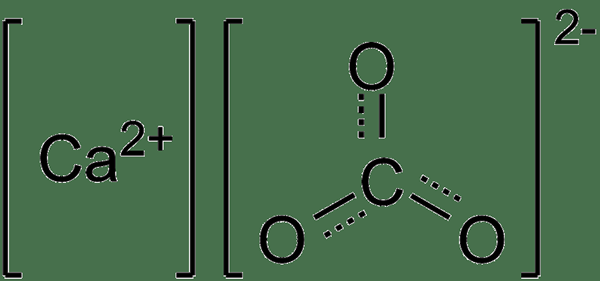
Le carbonate de calcium est un sel inorganique ayant la formule chimique Caco3. Par conséquent, il contient un anion carbonate par un cation calcique. La masse molaire est de 100 g / mol, et elle apparaît comme une fine poudre blanche avec un goût crayeux. Le point de fusion est de 1339 ° C, et il n'a pas de point d'ébullition car il subit une décomposition à des températures élevées.
Lorsque l'on considère l'occurrence de ce sel, il existe sur la croûte terrestre en tant que minéraux de calcium tels que la calcite, l'aragonite, etc. Les coquilles d'oeufs, les coquilles d'escargots et les coquilles de mer sont les sources biologiques. De plus, nous pouvons préparer ce composé via l'exploitation minière ou la carrière le minéral mentionné ci-dessus. Alternativement, nous pouvons le produire via la réaction d'oxyde de calcium avec de l'eau; Cela donne un hydroxyde de calcium. Ensuite, nous devons passer du dioxyde de carbone à travers ce produit pour obtenir du carbonate de calcium.

Figure 02: Structure chimique du carbonate de calcium
Les principales applications de ce composé se trouvent principalement dans l'industrie de la construction, où il est important en tant que matériau de construction. Par conséquent, c'est un ingrédient commun dans le ciment. De plus, c'est le composant principal de la craie de tableau noir. Il existe également des applications de santé et de diététique. C'est un complément de calcium alimentaire bon marché. En plus de cela, nous pouvons l'utiliser comme liant phosphate pour traiter l'hyperphosphatémie. En dehors de cela, il est utile comme remplissage pour les comprimés de l'industrie pharmaceutique.
Quelle est la différence entre le lactate de calcium et le carbonate de calcium?
Le lactate de calcium est un sel inorganique ayant la formule chimique C6HdixCao6. Il contient deux ions lactate pour chaque ion calcium. Parmi les données chimiques importantes, la masse molaire de ce composé est de 218.22 g / mol et le point de fusion est à 240 ° C. De plus, le lactate de calcium est utile comme antiacide, pour traiter l'hypocalcémie, comme un ingrédient dans la bouche et comme un additif alimentaire. Le carbonate de calcium, en revanche, est un sel inorganique ayant la formule chimique Caco3. Il contient un ion carbonate par chaque ion calcium. La masse molaire est de 100 g / mol et le point de fusion est de 1 339 ° C. En plus de cela, il est utile comme matériau de construction, comme craie à tableau noir, comme complément de calcium alimentaire bon marché, etc. L'infographie ci-dessous présente plus de détails sur la différence entre le lactate de calcium et le carbonate de cacalcium.
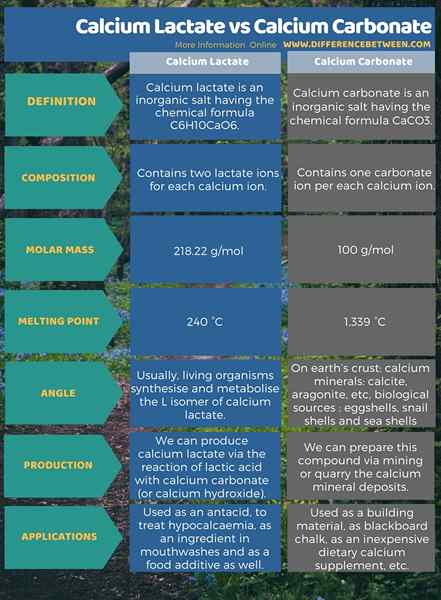
Résumé - Lactate de calcium vs carbonate de calcium
Le lactate de calcium et le carbonate de calcium sont des sels inorganiques de calcium. La différence entre le lactate de calcium et le carbonate de calcium est que le lactate de calcium contient deux ions de lactate pour chaque ion calcium tandis que le carbonate de calcium contient un ion carbonate par chaque ion calcique.
Référence:
1. «Lactate de calcium oral: utilisations, effets secondaires, interactions, images, avertissements et dosage.»WebMD, WebMD. Disponible ici
2. "Carbonate de calcium.»Wikipedia, Wikimedia Foundation, 27 juillet 2018. Disponible ici
Image gracieuseté:
1.'Calcium Lactate'By Edgar181 - Propre travaux, (domaine public) via Commons Wikimedia
2.'Calcium Carbonate'By Edgar181 (Talk) - Propre travaux, (domaine public) via Commons Wikimedia


