Différence entre la liaison et les orbitales moléculaires antibondantes
Liaison vs orbitales moléculaires anti-obondantes
La différence entre la liaison et les orbitales moléculaires antibondantes peuvent être mieux expliquées en utilisant «la théorie orbitale moléculaire."Ces deux types d'orbitales moléculaires se forment lorsque des liaisons chimiques covalentes se forment. La différence la plus significative entre la liaison et les orbitales moléculaires antibondantes est leur niveau d'énergie par rapport aux orbitales atomiques parentaux. Cette différence de niveau d'énergie entraîne d'autres différences entre deux orbitales moléculaires.
Liaison et orbitales moléculaires anti-adhérentes sont formées par une combinaison linéaire orbitales atomiques. Les concepts clés suivants sont très importants, pour comprendre la différence entre la liaison et les orbitales moléculaires anticondables.
Principe AUFBAU - Les orbitales avec la plus basse énergie sont remplies en premier.
principe d'exclusion de Pauli - Le nombre maximum d'électrons (avec des spins opposés) qui peuvent occuper une orbitale est deux.
La règle de Hund - Lorsqu'il y a plusieurs orbitales moléculaires avec une énergie égale, les électrons occupent les orbitales moléculaires une à la fois avant que deux occupent la même orbite moléculaire.
Que sont les orbitales moléculaires de liaison?
Des orbitales moléculaires de liaison se forment des orbitales atomiques par en phase combinaison d'orbitales atomiques. Il augmente la densité électronique entre les atomes liés. Leur énergie est inférieure aux orbitales atomiques. Les électrons sont d'abord remplis des orbitales moléculaires de liaison et ils stabilisent la molécule car ils associent moins d'énergie que l'électron dans l'atome parent.
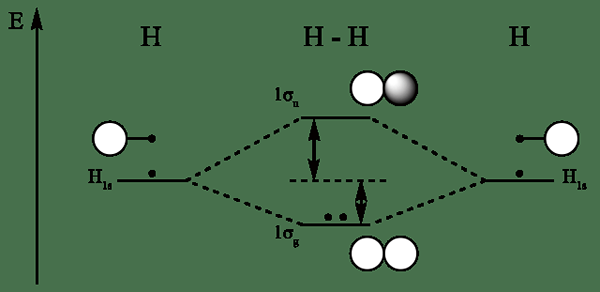
Diagramme orbital moléculaire pour l'hydrogène
Quelles sont des orbitales moléculaires anti-adhérentes?
Les orbitales moléculaires anti-adhérentes sont formé par déphasées combinaison d'orbitales atomiques et il diminue la densité électronique entre deux atomes. Dans les orbitales moléculaires antibondantes, l'énergie est plus élevée que les orbitales atomiques qui les ont formées. De ce fait, lorsque les électrons sont remplis dans des orbitales moléculaires antibondantes, il déstabilise la liaison entre deux atomes.

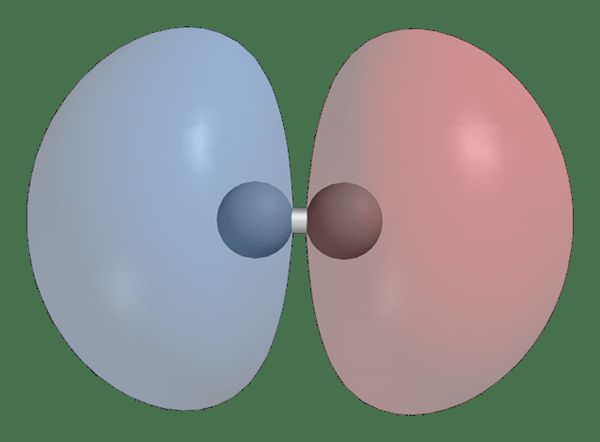
H2 1Sσ * Orbital moléculaire antibondant
Quelle est la différence entre les orbitales moléculaires de liaison et les orbitales moléculaires anti-aléatoires?
• Énergie:
ÉNERGIEOrbitales moléculaires antibondantes > ÉnergieOrbitales moléculaires de liaison
• Les orbitales moléculaires de liaison ont une énergie plus faible par rapport à l'orbitale atomique parent.
• Les orbitales moléculaires antibondantes possèdent une énergie élevée que celle des orbitales atomiques parentales.
• Généralement, les électrons sont d'abord remplis de niveaux d'énergie inférieurs. Par conséquent, les électrons sont d'abord remplis de liaison des orbitales moléculaires, puis d'orbitales moléculaires anti-aléatoires.
• La stabilité:
• Les orbitales moléculaires de liaison sont plus stables que les orbitales moléculaires anticonteuses et l'orbitale atomique parentale.
• Les orbitales moléculaires antibondantes sont moins stables que les orbitales moléculaires de liaison et les oubtials atomiques parentaux.
• La principale raison de la différence de stabilité est la différence de niveau d'énergie. Plus l'énergie est moins stabilité. La baisse de l'énergie est plus la stabilité.
• Disponibilité des électrons:
• La probabilité de trouver un électron est très élevée dans les orbitales moléculaires de liaison.
• Trouver un électron dans les orbitales moléculaires antibondantes est minimum.
• Contribution pour la forme de la molécule:
• Les orbitales moléculaires de liaison contribuent directement à la forme de la molécule.
• Les orbitales moléculaires antibondantes ne contribuent pas à la forme de la molécule.
Images gracieuseté:
- MO Diagramme Hydrogène par CCOIL (CC BY-SA 3.0)
- H2 1Sσ * Orbital moléculaire anti-objet via Wikicommons (domaine public)


