Différence entre le benzène et le cyclohexane
Le différence clé entre le benzène et le cyclohexane est que le Le benzène est un composé aromatique tandis que le cyclohexane est un composé non aromatique.
Le scientifique, Kekule a trouvé la structure benzène en 1872. En raison de l'aromaticité, le benzène est différent des autres composés aliphatiques. Ainsi, c'est un domaine d'étude distinct en chimie organique. D'un autre côté, bien que le cyclohexane ait une forme similaire au benzène, il n'est pas aromatique. Le cyclohexane est un alcane saturé, qui a des propriétés différentes de celle du benzène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le benzène
3. Qu'est-ce que le cyclohexane
4. Comparaison côte à côte - benzène vs cyclohexane sous forme tabulaire
5. Résumé
Qu'est-ce que le benzène?
Le benzène n'a que des atomes de carbone et d'hydrogène disposés pour donner une structure plane. Il a la formule moléculaire de C6H6. Sa structure et certaines des propriétés importantes sont les suivantes.
- Le benzène est un liquide incolore avec une odeur douce.
- Il est inflammable et s'évapore rapidement lorsqu'il est exposé.
- Utile comme solvant, car il peut dissoudre de nombreux composés non polaires.
- Il est légèrement soluble dans l'eau.
- Délocalisation des électrons Pi.
Structure du benzène
La structure du benzène est unique par rapport aux autres hydrocarbures aliphatiques. Par conséquent, le benzène a des propriétés uniques. Tous les carbones du benzène ont trois sp2 orbitales hybrides. Deux sp2 Les orbitales hybrides de carbone se chevauchent avec SP2 orbitales hybrides de carbones adjacents de chaque côté. Autre sp2 L'orbital hybridé chevauche l'orbital s de l'hydrogène pour former une liaison σ.
De plus, les électrons dans les orbitales p de carbone se chevauchent avec les électrons p des atomes de carbone dans les deux côtés formant des liaisons Pi. Ce chevauchement d'électrons se produit dans les six atomes de carbone et produit par conséquent un système de liaisons Pi, qui se propagent sur toute la bague de carbone. Ainsi, nous disons que ces électrons deviennent délocalisés. La délocalisation des électrons signifie qu'il n'y a pas de liaisons doubles et simples alternées. Par conséquent, toutes les longueurs de liaison C-C sont les mêmes, et la longueur est entre les longueurs de liaison simple et double. À la suite de la délocalisation, le cycle benzène est stable, ainsi, réticent à subir des réactions d'addition, contrairement à d'autres alcènes.
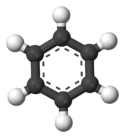
Figure 01: Modèle de bâton et de balle pour le benzène
Les sources de benzène comprennent des produits naturels ou divers produits chimiques synthétisés. Naturellement, il se produit dans la pétrochimie comme le pétrole brut ou l'essence. Concernant les produits synthétiques, le benzène est présent dans certains plastiques, lubrifiants, colorants, caoutchouc synthétique, détergents, médicaments, fumée de cigarette et pesticides. Le benzène est libéré sur la brûlure des matériaux ci-dessus. Par conséquent, l'échappement automobile et les émissions d'usine contiennent également du benzène. Surtout, il est cancérigène, donc l'exposition à des niveaux élevés de benzène peut provoquer un cancer.
Qu'est-ce que le cyclohexane?
Le cyclohexane est une molécule cyclique avec la formule de C6H12. Bien qu'il ait un nombre similaire de carbones comme le benzène, le cyclohexane est une molécule saturée. Par conséquent, il n'y a pas de double liaison entre les carbones comme dans le benzène. De plus, c'est un liquide incolore avec une odeur douce douce.

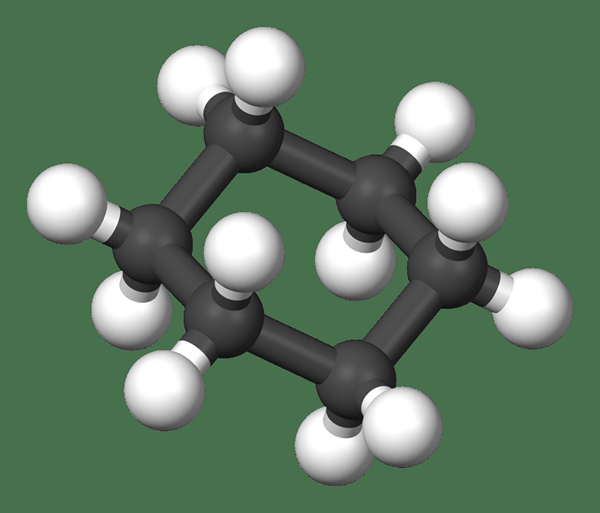
Figure 02: Modèle de balle et de bâton pour le cyclohexane
De plus, nous pouvons produire ce composé via la réaction entre le benzène et l'hydrogène. Puisqu'il s'agit d'un cycloalkane, il n'est pas réactif. De plus, il est non polaire et hydrophobe. Par conséquent, cela est utile comme solvant non polaire dans les applications de laboratoire. De plus, le cyclohexane est l'un des cycloalkane les plus stables, car sa déformation annuelle totale est minimale. Ainsi, il produit le moins de chaleur lors de la combustion par rapport aux autres cycloalcanes.
Quelle est la différence entre le benzène et le cyclohexane?
Le benzène est un composé organique ayant la formule chimique C6H6 et une structure planaire tandis que le cyclohexane est une molécule cyclique avec la formule de C6H12. La principale différence entre le benzène et le cyclohexane est que le benzène est un composé aromatique tandis que le cyclohexane est un composé non aromatique. C'est parce qu'il n'y a pas de double liaison entre les atomes de carbone dans l'anneau de cyclohexane. Une autre différence importante entre le benzène et le cyclohexane est que le benzène est une molécule insaturée tandis que le cyclohexane est une molécule saturée. C'est parce que le benzène a des atomes de carbone dans le ring avec SP2 hybridation tandis que le cyclohexane a des atomes de carbone dans l'anneau avec SP3 hybridation.
L'infographie ci-dessous de la différence entre le benzène et le cyclohexane montre plus de différences entre les deux.

Résumé - Benzène vs Cyclohexane
Le benzène et le cyclohexane sont tous deux des structures annulaires à six chaînons. Mais ils diffèrent les uns des autres en fonction de la liaison chimique entre les atomes de carbone; Ainsi, la géométrie des molécules. Étant donné que la liaison entre les atomes de carbone détermine l'aromaticité des molécules, nous pouvons souligner que la différence clé entre le benzène et le cyclohexane AS; Le benzène est un composé aromatique tandis que le cyclohexane est un composé non aromatique.
Référence:
1. "Benzène.»Wikipedia, Wikimedia Foundation, 27 septembre. 2018. Disponible ici
2. «Cyclohexane.»Wikipedia, Wikimedia Foundation, 10 octobre. 2018. Disponible ici
Image gracieuseté:
1.«Benzène-aromat-3d-balls» par Benjah-Bmm27 - Propre travaux, (domaine public) via Commons Wikimedia
2.«Cyclohexane-chair-3d-balls» (domaine public) via Commons Wikimedia


