Différence entre équation équilibrée et équation ionique nette

Différence clé - Équation équilibrée vs équation ionique nette
Toutes les réactions chimiques peuvent être écrites comme une équation. Les composants de cette équation comprennent les réactifs avec leurs états physiques, une flèche pour montrer la direction de la réaction et les produits de réaction avec leurs états physiques. S'il y avait des conditions spéciales utilisées, ils sont également écrits brièvement sur la flèche. Si la réaction est en équilibre, deux demi-flèches sont utilisées dans des directions opposées. Une équation chimique peut être écrite de deux manières: en tant qu'équation équilibrée ou en tant qu'équation ionique nette. La principale différence entre l'équation équilibrée et l'équation ionique nette est que L'équation équilibrée montre toutes les réactions qui ont eu lieu dans un système ensemble alors que L'équation ionique nette ne montre que la réaction nette qui s'est produite après l'achèvement de cette réaction particulière.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une équation équilibrée
3. Qu'est-ce qu'une équation ionique nette
4. Comparaison côte à côte - équation équilibrée vs équation ionique nette
5. Résumé
Qu'est-ce qu'une équation équilibrée?
Les réactions chimiques sont très importantes pour comprendre le comportement d'un système particulier. En écrivant la bonne équation pour la réaction, on peut avoir une idée des changements de différentes espèces dans ce système. Pour des réactions simples telles que la dissolution du NaCl dans l'eau, l'équation peut être écrite facilement en prédisant les produits possibles de cette réaction. Mais pour d'autres réactions complexes, d'autres tests peuvent devoir être effectués afin de découvrir les produits de ce système particulier. Mais la plupart du temps, l'équation écrite est très susceptible d'être déséquilibrée, ce qui rend difficile d'expliquer le comportement chimique de ce système. Par conséquent, les équations déséquilibrées devraient également être équilibrées. L'équation équilibrée comprend tous les réactifs et produits de ce système. L'équation est écrite en considérant le composé de réactif comme une molécule. Par exemple, l'équation équilibrée entre Ki et PBNO3 (si ceux-ci étaient réagis dans l'eau) serait;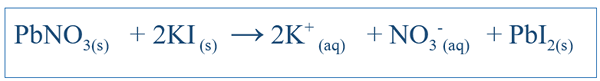
L'importance d'une équation équilibrée est qu'elle révèle les quantités de réactifs qui devraient être ajoutés en donnant des détails sur les relations stoechiométriques entre les espèces du système. Dans l'exemple ci-dessus, le rapport entre PBNO3 et Ki devrait être 1: 2 lors de l'ajout de ces composants dans le système.
Qu'est-ce qu'une équation ionique nette?
L'équation ionique nette ne montre que la réaction globale qui a eu lieu dans le système. Il comprend les espèces ioniques et les produits formés. Mais cela n'indique pas toutes les réactions qui se sont produites dans un système particulier. Par exemple, s'il y a une réaction entre deux molécules utilisant l'eau comme milieu, les composés peuvent s'être dissous dans l'eau et séparés en ions. Certains de ces ions peuvent être impliqués dans la réaction, mais certains peuvent ne pas. Alors l'équation ionique nette ne comprend que les ions qui ont participé à une réaction nette. D'autres ions, appelés ions spectateurs, sont éliminés de l'équation pour obtenir l'équation ionique nette. Par exemple, si Ki et PBNO3 réagi dans l'eau, la réaction ionique nette serait;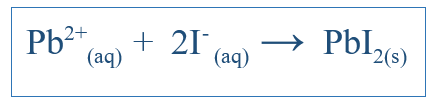
Cela devrait également inclure K+ ion et no3- ion, mais ces ions ne se dissolveront et ne participeront pas à la réaction majeure; Ainsi, ils ne sont pas inclus dans la réaction ionique nette.
Quelle est la différence entre l'équation équilibrée et l'équation ionique nette?
Équation équilibrée vs équation ionique nette | |
| Tous les composants utilisés sont écrits comme réactifs dans l'équation équilibrée. | Les réactifs qui n'étaient impliqués que dans la réaction net seraient écrits dans la réaction ionique nette. |
| Des produits | |
| Tous les composants à la fin de la réaction sont inclus dans une équation équilibrée. | Dans une équation ionique nette, seul le produit de fin net est écrit. |
| Détails donnés | |
| L'équation équilibrée donnera des détails sur toutes les espèces qui sont dans le système. | L'équation ionique nette donne des détails uniquement sur les espèces qui ont participé à la réaction |
Résumé - Équation équilibrée vs équation ionique nette
Lorsque certains composés ioniques sont ajoutés à l'eau, ils se séparent et forment des ions dissous dans l'eau. Cela produit des anions et des cations. Pour montrer les espèces produites après l'achèvement de la réaction et la direction de la réaction, une équation chimique peut être écrite. Cette équation peut être équilibrée compte tenu du nombre d'atomes de chaque espèce qui résident des deux côtés de la flèche; Parfois, même la charge de ces espèces doit être considérée. Cela donne une équation chimique équilibrée pour ce système particulier. Cependant, l'équation ionique nette ne comprend que les espèces réagies. Comme indiqué précédemment, la principale différence entre l'équation équilibrée et l'équation ionique nette est que l'équation équilibrée montre toutes.
Les références:
1. Chang, R., 2010. chimie. 10e édition. Newyork: McGraw-Hill.
2. Réactions chimiques. (n.d.). Récupéré le 26 mai 2017 de http: // www.ric.edu / faculté / ptiskus / réactions /
3. Équations ioniques et nettes complètes. (n.d.). Récupéré le 26 mai 2017 de https: // www.khanacademy.Org / Science / Chemistry / Chemical-Reactions-Stoichiome / Types de réaction chimique / A / Equation complète-ionique et net-ionique.


